Homonukleära diatomiska molekyler
i atomer, som du vet, elektroner bor i orbitaler av olika energylevels som 1s, 2s, 3d, etc.Dessa orbitaler representerar sannolikhetsfördelningen för att hitta anelektron någonstans runt theatom. Molekylär orbitalteori ger uppfattningen att elektroner imolekyler också existerar likgiltiga orbitaler som ger sannolikheten att hitta elektronen vidpartikulära punkter runt molekyl., För att producera uppsättningen orbitaler för en molekyl lägger vitillsammans Valens atomicwavefunctions för de bundna atomerna i molekylen. Detta är inte så komplicerat som det kanske låter. Låt oss överväga bindningen ihomonukleära diatomicmolecules–molekyler av formeln A2.
kanske är den enklaste molekylen vi kan föreställa oss väte, H2.As vi har diskuterat, för att producera molekylära orbitaler för väte, lägger vi till ihopvalens atomicwavefunctions för att producera molekylära orbitaler för väte. Eachhydrogen atom inH2 har bara 1s orbital, så lägger vi till två 1swavefunctions., Som du har lärt dig i din studie av atomstruktur kan atomvågor ha antingen plus eller minusfaser-det betyder värdet av vågfunktionen yis antingen positivt ellernegativt. Det finns två sätt att lägga till vågfunktionerna, antingenbåde i fas (antingen bothplus eller båda minus) eller out-of-phase (ett plus och det andra minus).visar hur atomvågfunktioner kan läggas ihop för att producera molekylärorbitaler.
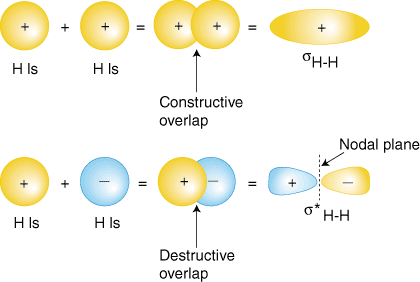
kombinationen av överlappning i fas (toppuppsättning av orbitaler i ) ger en uppbyggnad av elektrondensitet mellan de två kärnorna vilket resulterar i en kraftigare energi för den orbitalen.De elektroner som upptar sH-Horbital representerar detbindande paret elektroner från Lewis-strukturen i H2 och heter passande molekylär orbital. Den andra molekylära orbital som produceras, S * H-H visar en minskning av elektrondensitetenmellan kärnorna ett värde av noll vid mittpunkten mellan kärnorna där det finnsett nodalt plan., Eftersom S * H-H-orbitalen visar en minskning av bindningmellan tvåkärnorna kallas den en antibonding molekylär orbital. På grund av minskningen av elektrondensiteten mellan kärnorna är den antibonding orbital högre i energi än både bindningsbanden och hydrogen 1s orbitaler. I molekylen H2 upptar inga elektroner den antibonding orbitalen.,
för att sammanfatta dessa fynd om de relativa energierna i bindningen,antibonding och atomicorbitals, kan vi konstruera ett orbital korrelationsschema, shownin:
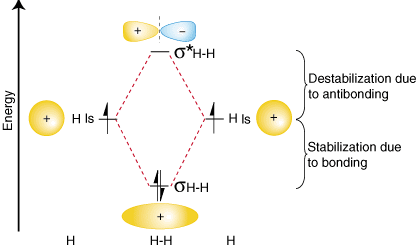
meddelande att de separerade atomernas orbitaler är skrivna på vardera sidanav diagrammet som horisontalliner i höjder som betecknar deras relativa energier. Elektronerna i varjatomisk orbital representerasgenom pilar., I mitten av diagrammet skrivs de molekylära orbitalerna avmolekyl av intresse. Streckade linjer förbinder de överordnade atomiska orbitalerna med dotternmolekylära orbitaler. Ingeneral, bindning molekylära orbitaler är lägre i energi än någon av sina moder atomära orbitaler.På samma sätt är antibonding orbitaler högre i energi än någon av desssparent atomiska orbitaler. EftersomVi måste lyda lagen om bevarande av energi, mängden stabilisering av bindningen orbitalmåste motsvara mängden destabilisering av antibonding orbital, som shownabove.,
Du kanske undrar om Lewis-strukturen och den molekylära orbitalbehandlingen av vätemoleculeagree med varandra. Det gör de faktiskt. Lewis-strukturen forH2 är H-H, förutsägandeen enda bindning mellan varje väteatom med två elektroner i bindningen.Den orbital korrelationdiagram i förutspår samma sak — två elektronerfyller en enda bindning molecular orbital. För att ytterligare visa konsistensen av Lewisstrukturerna med Moteori kommer vi att formalisera en definition av bindningsordning-antalet bindningar mellan atomer i en molekyl.,Bondordningen är skillnaden i antalet elektronpar som upptaren antibonding och motsvarande molekylär orbital. Eftersom vätgas har en elektron pairin dess bindning orbital andnone i sin antibonding orbital, molekylär orbital teori förutspår att H2 har en bondorder av en-samma resultat som härrör från Lewis strukturer.