Affiliate Disclosure: jag får en liten provision för inköp som görs via affiliate länkar.
mitt i att undervisa några gymnasieelever om kemi av tvåltillverkning insåg jag att jag verkligen ville försöka göra lite tvål själv och skriva om det här. Min uppskrivning slutade vara riktigt lång, så jag har gjort det till en tvådelare-avbetalning 1 handlar om kemi, och avbetalning 2 handlar om det faktiska förfarandet (som du också kan göra hemma med utrustning och kemikalier från snabbköpet!).,

du behöver inte förstå kemin bakom tvåltillverkning för att göra tvål, men att veta bakgrunden betyder att du kan leka med dina recept och lösa eventuella problem du stöter på med minimal trial-and-error och slöseri! Det är också mycket intressant ur vetenskaplig synvinkel.
Hoppa till avsnitt:
- Vad är tvål?,
- gör tvål-Förtvålningsreaktionen
- fetter och oljor
- stark bas
- proportioner
- Glycerin
- sammanfattning
innan vi kan börja med nitty gritty av kemiska reaktioner-vad är ens tvål?
Vad är tvål?
om du har följt mig ett tag kommer du ihåg att jag nämnde kemikalier som kallas ytaktiva ämnen, till exempel i min gästpost på kemofobi på Toast och i den här tvättguiden., Ytaktiva ämnen är nifty molekyler som löses upp i både vatten-och oljebaserade ämnen, vilket innebär att de kan rengöra olje-och oljebaserade ytor och hålla blandningar av olja och vattenbaserade vätskor lyckliga tillsammans (tänk majonnäs – utan äggula som fungerar som ett ytaktivt medel som håller allt blandat, det skulle bara separera i vinagrette dressing).
ytaktiva ämnen har ett laddat vattenälskande, hydrofilt ”huvud” och en neutral, oljeälskande, lipofil ”svans”.
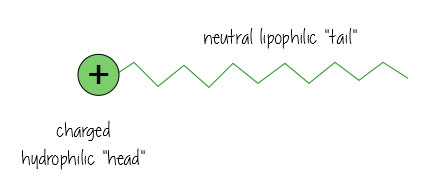
Så här ser det ut när det löser upp olja i vatten (t. ex., i din smutsiga badvatten, eller hålla fettet löst i mjölken) – ytaktiva ämnen hänga i gränssnittet mellan olja och vatten, hålla allt tillsammans.
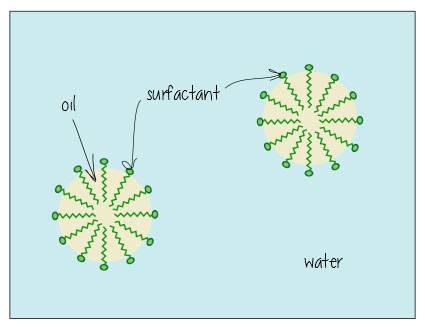
tvålar ser ut så här:
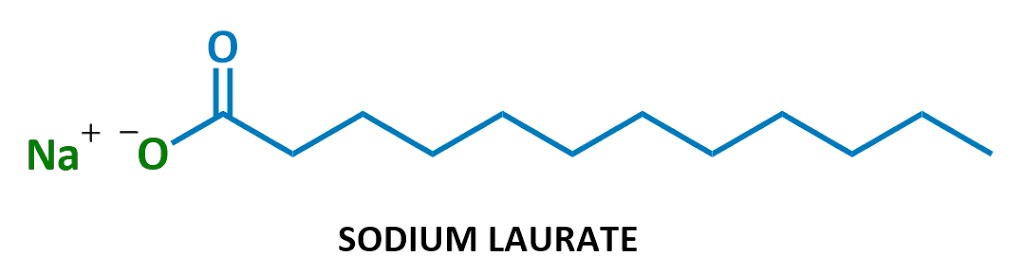
denna speciella tvålmolekyl det kallas natriumlaurat. När det löses upp i vatten delas natrium (Na+ till vänster) och laurat (resten av diagrammet) upp., Här är laurate ion:
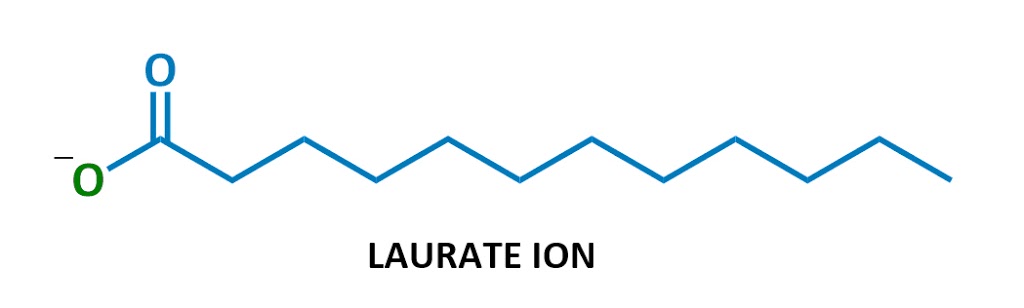
ser bekant ut?

Japp, tvålar är negativt laddade ytaktiva ämnen! De är en del av en klass av kemikalier som kallas anjoniska ytaktiva ämnen (anjoniska = negativt laddade), vilket inkluderar de starkaste rengöringsmedel. (Tekniskt tvålar kallas ” salter av fettsyror – – jag kommer inte använda denna terminologi mycket men det är här om du någonsin behöver det.)
Så, hur får vi dessa användbara saker i våra smutsiga små händer?,
gör tvål – Förtvålningsreaktionen
tvål är gjord av att reagera ett fett eller olja (eller en blandning) med en stark bas (något med mycket högt pH). De kemiska strukturerna av fetter och oljor ser i allmänhet ut så här:
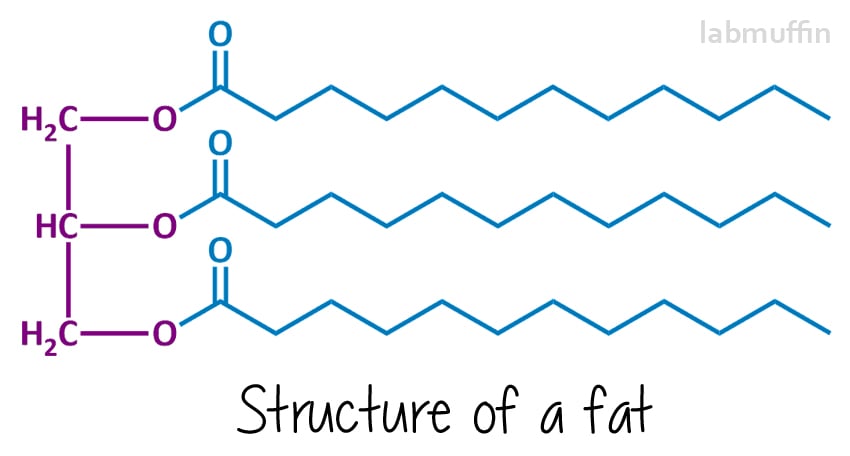
vänster sida (lila) är alltid densamma – den är baserad på en glycerin (aka glycerol) molekyl. Varje ” O ” representerar en syreatom-det finns 3 på glycerol, och dessa är kemiskt fästa vid 3 fettsyror (i blått, vilket kommer att sluta vara tvålen)., Dessa kan alla vara samma eller olika(i den här ritningen har jag ritat dem alla samma). Eftersom det finns tre saker och de är förenade med en glycerinmolekyl, kallas fetter och oljor triglycerider.
tvåltillverkningsreaktionen kallas förtvålning, och efter reaktion sägs blandningen vara förtvålad. Förtvålning innebär att reagera fett eller olja med en stark bas, vanligtvis natriumhydroxid (aka lye aka kaustisk soda), även om du också kan använda kaliumhydroxid (aka kaustisk potash)., Denna reaktion bryter triglyceriden i de lila och blå delarna, med andra ord glycerin-och tvålmolekylerna.
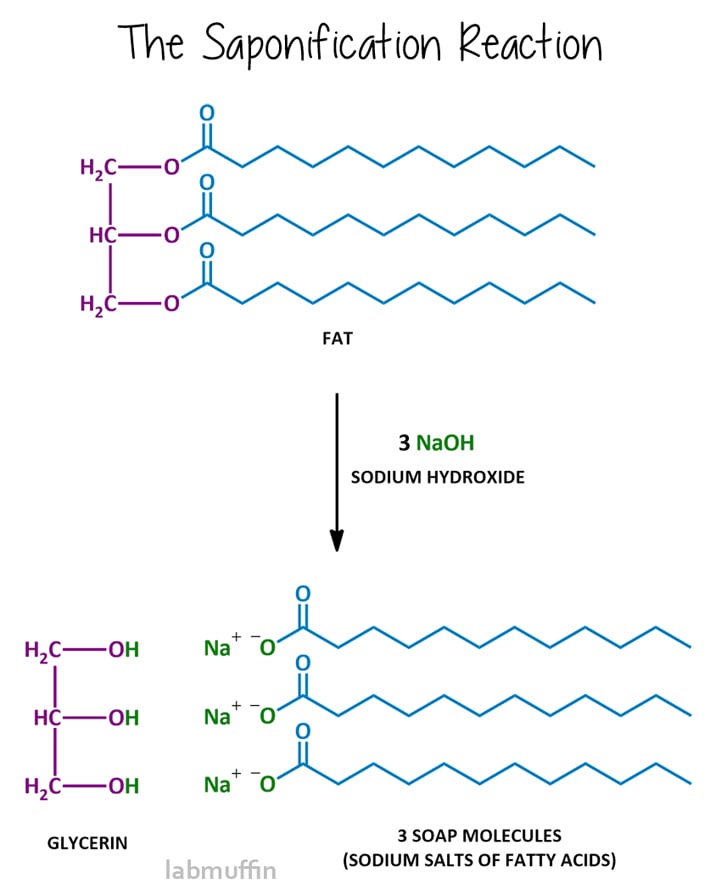
låt oss titta närmare på varje komponent i reaktionen:
fetter och oljor
detta är den mest komplicerade och intressanta delen av receptet. Olika fetter och oljor kan användas för att göra tvål med olika egenskaper. I fetter och oljor skiljer sig fettsyrorna (det är den blå delen, kom ihåg).
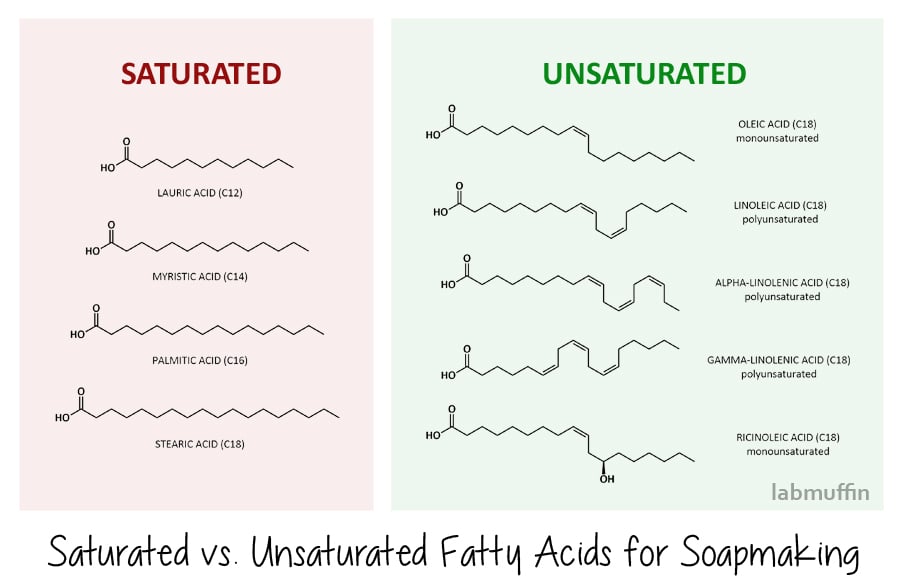
det finns två huvudtyper av fettsyror: mättade och omättade., (Detta är detsamma som de mättade och omättade fetterna som du hör om från dietister!)
mättade fettsyror har en enkel zig-zag i sin struktur. De vanliga vi använder i tvåltillverkning är laurinsyra, myristinsyra, palmitinsyra och stearinsyra, som visas nedan. Det innebär att när de staplar ihop snyggt på molekylär nivå både före och efter förtvålning, bildar hårdare tvålar (och hårdare blockeringar i dina artärer, om du äter dem)., Tvål gjorda av mättade fettsyror är också effektivare vid rengöring-men det betyder att de tar bort mer naturlig olja från din hud också.
klicka på bilden för att visa större version
omättade fettsyror har veck i sin struktur, på grund av att det finns dubbelbindningar (bitarna där zig zag blir två parallella linjer)., Vanliga omättade fettsyror som används i tvåltillverkning är oljesyra, linolsyra, alfa – och gamma-linolensyra (dessa är också kända som omega fettsyror – igen, något du kanske har stött på tidigare i samband med näring) och ricinolsyra. På grund av sin kinky form staplar de inte snyggt på molekylär nivå och kan glida runt med många luckor, vilket innebär att du hamnar med mjukare tvålstänger (och de täpper inte till artärer om du äter dem). Tvålar gjorda av omättade fettsyror är mindre effektiva vid rengöring och är därför mildare på huden.,
liksom hårdheten hos din tvål och dess rengöringsförmåga, kommer mängden av varje förtvålad fettsyra i den slutliga tvålen också att påverka hur löddret beter sig. I allmänhet kommer mättade fettsyror att ge dig ett krämigt, stabilt lödder, medan omättade fettsyror kommer att resultera i ett fluffigt men instabilt lödder. Ett anmärkningsvärt undantag är dock ricinolsyra (finns i ricinolja), som är omättad men ger en rik, fluffig lödder som är ganska stabil också. Omättade fettsyror tenderar också att gå rancid lättare, eftersom dubbelbindningen kan reagera.,
(sidoanteckning: animaliska och vegetabiliska fetter och oljor är triglycerider – mineralolja och andra oljor som härrör från petroleum är å andra sidan inte triglycerider, så det är omöjligt att göra tvål från dem.)
Du kan också enkelt slå upp fettsyraprofilerna av vanliga fetter och oljor – de kommer att skilja sig åt för varje sats olja, så de är verkligen ballpark siffror., Här är de tre oljorna jag ska använda i projektet (info från denna fantastiska tvålkalkylator):
stark bas
baserna som används för soapmaking måste innehålla hydroxid – det är det som fungerar för att bryta upp fettet eller oljan i glycerin och tvål. Natriumhydroxid och kaliumhydroxid är de 2 vanligaste baserna för förtvålning.
natriumhydroxid (även känd som lut eller kaustiksoda) används oftast och resulterar i en hård bar. Kaliumhydroxid resulterar i en mjuk bar och används vanligtvis för att göra flytande tvål., Anledningen till skillnaden är att natriumjonen är lite mindre än kaliumjonen-det stör mindre med staplingen av tvålmolekylerna på molekylär nivå, och precis som med mättade vs omättade fettsyror ovan, desto effektivare stapling desto hårdare blir den resulterande tvålen.
säkerhetsanteckning: starka baser är ganska otäcka saker att leka med-precis som starka syror kommer de att bränna din hud direkt. Minns du scenen från Fight Club? Det är inte bara konstnärlig licens – du kommer att sluta med ett permanent ärr!, Jag går mer in i säkerhetshänsyn för tvåltillverkning i nästa inlägg.
proportioner
i reaktionsschemat ovan märker du att du behöver 3 baspartiklar för att reagera med en fett-eller oljepartikel. Molekyler är löjligt små, så vi kan inte sitta och räkna ut det exakta antalet vi behöver blanda i vår kastrull. De av er som har studerat kemi vet att det finns en metod för att beräkna förhållandet mellan komponenter, men fetter och oljor tenderar att innehålla blandningar av fettsyror snarare än en enda slags molekyl, så det är inte en enkel uppgift!,
lyckligtvis finns det massor av tvålkalkylatorer och förtvålningstabeller online med förprogrammerade nummer som kan göra det smutsiga arbetet för oss – här är några. (Om du använder en särskilt avancerad tvålkalkylator, kommer den också att beräkna de förutsagda egenskaperna hos tvålen gjord av vilken blandning av fetter och oljor du har valt, bara från %s av varje fettsyra, vilket verkligen är snyggt.,)
dessa räknare låter oss räkna ut vad de perfekta proportionerna skulle vara, men kom ihåg att vi inte använder super exakta vetenskapliga instrument – vi använder köksvågar, som kommer att väga en hel del molekyler av (och med en hel del menar jag i regionen 2,500,000,000,000,000,000,000 – det är antalet NaOH-partiklar i ett measly gram). Om vi inte har tillräckligt med bas, kommer det att finnas för mycket fett/olja kvar i slutet – slapping fett på huden låter inte mycket rengöring!, Å andra sidan, om vi inte har tillräckligt med fett/olja, har vi stark bas kvar i slutet i tvålstången-aj!
hur vi spelar det säkert är genom supermatting, vilket innebär att lägga till lite mindre hydroxid än vad vi behöver-tillräckligt för att vara säkra, men inte så mycket att tvålen hamnar för fet. Detta kallas också en lut rabatt, och är vanligtvis runt 5-8%.
Glycerin
detta är den produkt som är densamma i alla förtvålningsreaktioner., Glycerin är en fuktighetskräm, vilket innebär att det drar vatten till huden för att lägga till fukt (det är de saker som gör denna DIY nagellackfjernare så närande!). Men det betyder också att det lockar vatten till din sista tvål, vilket gör att det blir mush om du inte är försiktig. Kommersiellt massproducerade tvål tar vanligtvis bort mycket glycerin för att komma runt denna fråga, och vissa handgjorda tvål gör också (med en process som kallas ”saltning ut”), men det här är lite mer avancerat än vi behöver för detta projekt.,
sammanfattning
- tvålar är ytaktiva ämnen, vilket innebär att de löses upp i vatten och oljor och kan rengöras.
- Soapmaking innebär att man reagerar fetter/oljor med en stark hydroxidbas för att bilda glycerin och tvål (salter av fettsyror).
- fett/oljemolekyler (triglycerider) består av glycerin kemiskt fäst vid 3 fettsyror.
- de specifika fettsyrorna i fetterna/oljorna du reagerar bestämmer egenskaperna hos din slutliga tvålstång.,
- den starka hydroxidbasen du använder för att göra en tvålstång kommer förmodligen att vara natriumhydroxid, som har ett högt pH
- för att beräkna hur mycket av varje kemikalie du behöver i din reaktion, måste du använda en tvålkalkylator eller förtvålningstabell.
- du vill ha lite överflödigt fett / olja (5-8%) i ditt recept, för att vara en smula fet (fuktad) är bättre än att bränna din hud av! Detta kallas superfatting.
det är kemin bakom soapmaking i ett (ganska stort) nötskal., Men hur går vi från det här till att faktiskt ha en tvål att använda på din kropp? Del 2 kommer att handla om processen-vi ses då!

