US Pharm. 2019;44(1):20-23.
abstrakt: Alzheimers sjukdom (AD) blir allt vanligare över hela världen. Fyra läkemedel (donepezil, rivastigmin, galantamin och memantin) är godkända för behandling av AD-symtom. Trots omfattande forskning under de senaste hundra åren är lite känt om vad som orsakar AD eller hur man effektivt behandlar det. Framsteg görs dock i att belysa den komplexa patofysiologin som leder till utvecklingen av plack och tangles, två dominerande bidragande faktorer i AD., Denna kunskap har underblåst forskning som syftar till att utveckla sjukdomsmodifierande medel för att stoppa sjukdomsprogressionen. Aktuell forskning fokuserar på agenter som riktar sig till sekretasenzymer för att förhindra plackackumulering. Även om forskningen verkar lovande har dessa agenter producerat få framgångsrika resultat. Apotekaren kan se till att patienter tar sina annonsmedicin ordentligt, kommunicerar med patienter och vårdgivare om behandlingsförväntningar och informerar dem om nya terapier.
Alzheimers sjukdom (AD) är den vanligaste neurodegenerativa sjukdomen i världen. Cirka 5.,5 miljoner människor i USA och 47 miljoner människor världen över påverkas för närvarande.1,2 tretton procent av personer som är äldre än 65 år och 45 procent av dem som är äldre än 85 år har AD, och prevalensen ökar.3 Det förväntas att ett nytt fall av annons senast 2050 kommer att utvecklas var 33: e sekund och uppgå till nästan en miljon nya fall per år.4 på grund av bristen på effektiva behandlingsalternativ ökar kostnaden för vård av ANNONSPATIENTER i USA—uppskattat till mer än 183 miljarder dollar årligen—, tillsammans med en motsvarande ökning av belastningen på patienternas nära och kära.,2 även om AD har studerats i mer än hundra år är kunskap och förståelse för detta komplexa tillstånd långt ifrån fullständigt. För närvarande utförs omfattande forskning för att bestämma vad som orsakar AD och att upptäcka effektiva behandlingar.
patofysiologi
1906 beskrev neuropatologen och psykiatern Alois Alzheimer abnormiteter som hittades i hjärnan hos en patient som hade demens. Även om orsaken till AD fortfarande inte är fullständigt förstådd, verkar amyloidplakor och neurofibrillära trassel vara de dominerande bidragande faktorerna., Produktionen och ackumuleringen av plack och trassel antas vara associerad med synaptisk dysfunktion och neuronal degenerering som resulterar i en långsamt progressiv och irreversibel försämring av minnet, vilket i slutändan påverkar språk, personlighet och kognition.2,3 amyloidplakor består främst av beta-amyloidproteiner, som härrör från ett moderprotein som kallas amyloidprekursorprotein (APP). Tre sekretasenzymer-alfa -, beta – och gamma-sekretas—klyva APP i lösliga fragment och sedan rensa fragmenten., Amyloidplakor tros bildas när beta – och gammakrekretasenzymerna klyver olämpligt APP, vilket leder till skapandet av olösliga beta-amyloidproteiner, som ackumuleras för att bilda plack i hjärnan; neurotoxicitet och celldödsresultat.2,3,5,6 neurofibrillära tanglar är aggregat av överfosforylerade tau-proteiner. Tau-proteiner innehåller naturligt fosfatmolekyler; i AD är dessa proteiner hyperfosforylerade, vilket gör att Tau-proteinerna vrider sig runt varandra och bildar olösliga Trassel som stör neuronal transport., Figur 1 visar olämplig klyvning av APP av beta-och gammakrekretasenzymer.3,4,6
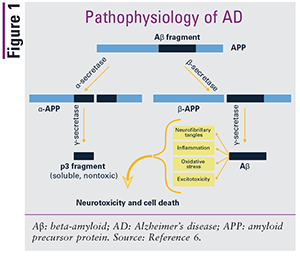
även om neuropatologer tror att plack och trassel är den mest sannolika orsaken till annons, finns flera andra möjliga bidragande faktorer. Det verkar finnas en genetisk mekanism för AD i vissa familjer, med E4-allelen av apolipoprotein E (ApoE) som ger den starkaste genetiska risken hittills identifierad.1 en av fem personer bär denna allel, och bärare är tre gånger mer benägna än noncarriers att utveckla AD.,1 ApoE spelar en roll vid bearbetning och clearing av APP, och man tror att bärare av E4-allelen inte kan effektivt rensa APP, vilket leder till ökad produktion och deponering av beta-amyloid. Dessutom är neuroninflammation tros vara en viktig faktor, presenterar som både en orsak och en följd av sjukdomen. Förmodligen är produktionen av plack och tangles åtminstone delvis på grund av inflammation som uppträder naturligt med åldrande., När de väl bildats orsakar plack och trassel mer inflammation, accelererar bildandet av ytterligare plack och trassel och leder till ytterligare kognitiv nedgång.1,3
även om majoriteten av forskningen fokuserar på beta-amyloidprotein och tau, har andra riskfaktorer för AD identifierats. Diabetes mellitus, medelålders hypertoni, medelålders fetma, fysisk inaktivitet, depression, rökning och låg utbildningsnivå har identifierats som modifierbara riskfaktorer för utvecklingen av AD., I en statistisk analys av flera metaanalyser uppskattades att ungefär en tredjedel av ad-Fallen över hela världen kan relateras till dessa riskfaktorer.7 Det kan vara möjligt att förhindra eller fördröja uppkomsten av AD genom att kontrollera dessa riskfaktorer.
nuvarande läkemedelsbehandlingar
fyra läkemedel är för närvarande tillgängliga för behandling av AD, och alla godkändes för mer än ett decennium sedan. Av dessa är de första linjens medel acetylkolinesteras (AChE) – hämmarna donepezil, rivastigmin och galantamin., Dessa läkemedel ökar nivåerna av acetylkolin—en viktig signalsubstans som är ansvarig för minne och kognitiv funktion-i hjärnan genom att förhindra enzymatisk nedbrytning av acetylkolin. Eftersom AChE-hämmare saktar progressiv kognitiv nedgång, är de godkända för att behandla demens hos patienter med AD.
det finns inga anmärkningsvärda skillnader i effektivitet mellan dessa medel.Donepezil är vanligen ordinerat eftersom det tolereras väl, men något av dessa medel kan användas för att initiera behandling., Alla patienter bör övervakas för förändringar i kognitiv funktion, symtom på gastrointestinal intolerans och viktminskning. American Geriatrics Society ’ s 2015 uppdaterade Ölkriterier för potentiellt olämplig medicinsk användning hos äldre vuxna innehåller en stark rekommendation, baserad på bevis av måttlig kvalitet, för att undvika användning av ache-hämmare hos patienter med en historia av synkope på grund av den ökade risken för bradykardi och ortostatisk hypotension.9 dock måste utövare väga specifika risker mot fördelar för sina geriatriska patienter.,2,9,10 se Tabell 1 för rådgivningspunkter för ache-hämmare.
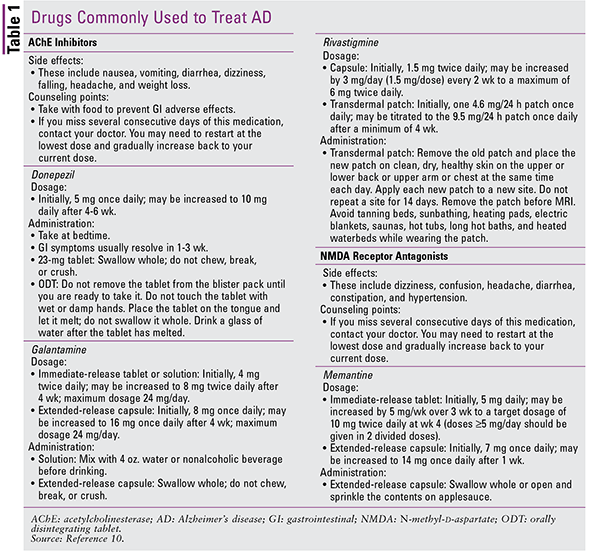
det fjärde medlet, memantin, är också godkänt för behandling av demens hos patienter med AD. Memantin är en N-metyl-d-aspartat-receptorantagonist som blockerar glutamat, en excitatorisk neurotransmittor i centrala nervsystemet, från bindning till dess receptorer. Detta förhindrar överdriven excitotoxicitet och neuronal celldöd, som tros bidra till patogenesen av AD., I det sena skedet av AD kan memantin kombineras med en ache-hämmare, och en kombinationsprodukt innehållande donepezil och memantin finns tillgänglig kommersiellt.2,6,10 viktiga rådgivningspunkter för memantin ges i tabell 1.
alla medel som används för AD saktar sjukdomsprogressionen och kan fördröja symptomutvecklingen, men de förbättrar inte signifikant kognitiv funktion eller botar sjukdomen. Dessa medel anses endast vara blygsamt effektiva, och den kliniska betydelsen av deras effektivitet är tveksam.,8 Det är viktigt för patienter och familjemedlemmar att förstå detta för att undvika orealistiska förväntningar.
aktuell forskning och möjliga nya Agenter
ökad förståelse för ads patofysiologi har lett till utveckling och testning av många nya medel för behandling. I AD narkotika-och utvecklingsportfölj för 2018, 112 agenter var i fas i, II, eller III-studier; 63% av dem är sjukdomsmodifierande behandlingar (DMTs) som syftar till att förändra kursen på ANNONS och förbättra resultaten snarare än att hantera symtomen.,11 ungefär en fjärdedel av drogerna i utveckling testas för deras förmåga att förbättra kognition, vilket kan leda till förbättrat minne, språk, tänkande och dom.cirka 10% av drogerna är avsedda att minska beteendemässiga symtom som agitation, apati och sömnstörningar.11, 12
de flesta DMTs som studeras target beta-amyloid-eller tauproteiner.13 hämning av sekretasenzymerna som är involverade i att generera beta-amyloidprotein från APP är en primär verkningsmekanism för många av drogerna.,11,14 Beta-site APP-cleaving enzyme (BACE) – hämmare riktar sig till de beta-sekretasenzymer som är involverade i det första steget av klyvningsapp, medan gamma-sekretashämmare verkar på det andra klyvningssteget.Många BACE-hämmare har visat förmågan att minska bildningen av beta – amyloidplakor, men de har inte visat sig vända befintliga plack eller förbättra kognitionen.13,15 dessutom, för att dessa medel ska vara användbara, måste de startas tidigt i sjukdomsprocessen, vilket är långt innan de flesta AD-patienter diagnostiseras.,15 eftersom BACE klyver många andra kritiskt viktiga proteiner i hjärnan förutom APP, måste forskning adressera metoder för att blockera beta-amyloidproduktion samtidigt som man minimerar oönskade negativa effekter.16 Gamma-sekretasmodulatorer modifierar gamma-sekretasenzymet för att minska beta-amyloidavsättning i hjärnan.13,17
ett framväxande fokus för sjukdomsmodifierande terapier är inriktningen på tau-protein, vilket är förknippat med neurofibrillära trassel.11 inledande studier på detta område, som omfattade minskning av tau aggregering, hade nedslående resultat., Dessa ansträngningar väckte emellertid fler frågor, och nya strategier testas på sju tau-immunoterapeuter i fas I och II-studier.11
många läkemedel som studeras för deras förmåga att lindra beteendemässiga symptom på AD godkändes tidigare för andra sjukdomar.12 Dessa repurposed läkemedel kan ibland flytta från preklinisk undersökning till fas II kliniska prövningar, vilket förkortar en agents tid i läkemedelsledningen.,Några exempel är escitalopram och mirtazapin (antidepressiva medel), karbamazepin och levetiracetam (antikonvulsiva medel), litium (stämningsstabilisator) och metylfenidat (stimulerande medel).12
utmaningar finns i överflöd i utvecklingen av effektiv behandling och DMTs för AD. Trots omfattande forskning har den definitiva bakomliggande orsaken till denna komplexa sjukdom ännu inte bestämts. Kombinationsterapier kommer sannolikt att krävas, men teststrategier har fokuserat på enstaka terapier., Nya terapier som testats i djurmodeller saknar ofta prediktivt värde hos människor, och många av de testade läkemedlen saknar effekt eller har oacceptabla biverkningsprofiler. Dessutom är det svårt att rekrytera och behålla volontärer för långa drogförsök, och kostnaden för att få ett kandidatläkemedel till marknaden är ofta oöverkomlig. Nya finansieringsstrategier måste utvecklas för att säkerställa att säkra och effektiva behandlingar utvecklas för att möta de akuta behoven hos ANNONSPATIENTER och deras nära och kära.,11,12,14
apotekarens Roll
på grund av AD komplexitet, nuvarande behandlingar mål symtomhantering och bara fördröja sjukdomsprogression. Nya kliniska studier förändrar AD-terapi genom att flytta fokus till sjukdomsmodifiering, men mer data är nödvändiga innan dessa produkter kan släppas ut på marknaden. Apotekaren är i ett idealiskt läge, inte bara för att säkerställa att patienterna tar sina annonsmedicin på ett säkert och effektivt sätt, men också för att informera dem om nya terapier., Som en av de mest tillgängliga vårdgivarna kan apotekaren också vara involverad i att kommunicera med familjemedlemmar och vårdgivare för att främja realistiska behandlingsförväntningar. Med tanke på att mer än hundra agenter är på gång, kommer apotekarens roll i förvaltningen av AD att fortsätta att expandera.