
Chemistry Tutorial
de chemie van Water
de polariteit van water
| Water heeft een eenvoudige moleculaire structuur. Het bestaat uit één zuurstofatoom en twee waterstofatomen. Elk waterstofatoom is covalent gebonden aan de zuurstof via een gedeeld paar elektronen. Zuurstof heeft ook twee niet-gedeelde paren elektronen. Zo zijn er 4 paren elektronen rondom het zuurstofatoom, twee paren betrokken bij covalente bindingen met waterstof, en twee niet-gedeelde paren aan de andere kant van het zuurstofatoom., Zuurstof is een” elektronegatief “of elektron” liefdevol ” atoom in vergelijking met waterstof.
Water is een” polair ” molecuul, wat betekent dat er een ongelijke verdeling van elektronendichtheid is. Water heeft een partiële negatieve lading ( een elektrostatische aantrekking tussen de partiële positieve lading bij de waterstofatomen en de partiële negatieve lading bij de zuurstof resulteert in de vorming van een waterstofbinding zoals in de afbeelding. |
 |
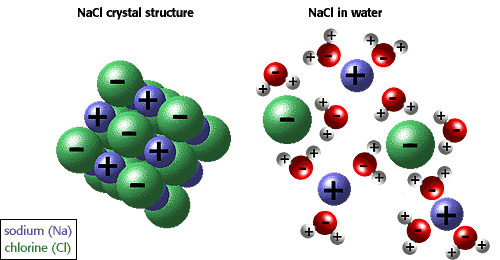
het vermogen van ionen en andere moleculen om op te lossen in water is te wijten aan polariteit. In de onderstaande afbeelding wordt bijvoorbeeld natriumchloride in kristallijne vorm weergegeven en opgelost in water.,
veel andere unieke eigenschappen van water zijn te wijten aan de waterstofbindingen. Ijs drijft bijvoorbeeld omdat waterstofbindingen watermoleculen verder uit elkaar houden in een vaste stof dan in een vloeistof, waar er één waterstofbinding minder is per molecuul. De unieke fysische eigenschappen, waaronder een hoge verdampingswarmte, sterke oppervlaktespanning, hoge soortelijke warmte en bijna universele oplosmiddeleigenschappen van water zijn ook te wijten aan waterstofbinding., Het hydrofoob effect, of de uitsluiting van samenstellingen die koolstof en waterstof bevatten (niet-polaire samenstellingen) is een andere unieke eigenschap van water veroorzaakt door de waterstofbindingen. Het hydrofobe effect is bijzonder belangrijk bij de vorming van celmembranen. De beste beschrijving is om te zeggen dat water “knijpt” niet-polaire moleculen samen.,
zuren en basen, ionisatie van Water
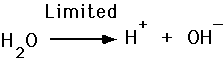
- Zuurafgifte h+
- basen accepteren H+
We definiëren de pH van een oplossing als de negatieve logaritme van de waterstofionenconcentratie.
- bij pH 7.,0, a solution is neutral
- at lower pH (1-6), a solution is acidic
- at higher pH (8-14), a solution is basic
![]()
![]()




 ) in de buurt van het zuurstofatoom vanwege de niet-gedeelde paren elektronen, en partiële positieve ladingen (
) in de buurt van het zuurstofatoom vanwege de niet-gedeelde paren elektronen, en partiële positieve ladingen ( ) in de buurt van de waterstofatomen.,
) in de buurt van de waterstofatomen.,