Chemie Tutorial
Die Chemie von Wasser
Die polarität von wasser
| Wasser hat eine einfache molekulare struktur. Es besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen. Jedes Wasserstoffatom ist über ein gemeinsames Elektronenpaar kovalent mit dem Sauerstoff verbunden. Sauerstoff hat auch zwei nicht geteilte Elektronenpaare. Somit gibt es 4 Elektronenpaare, die das Sauerstoffatom umgeben, zwei Paare, die an kovalenten Bindungen mit Wasserstoff beteiligt sind, und zwei nicht geteilte Paare auf der gegenüberliegenden Seite des Sauerstoffatoms., Sauerstoff ist ein“ elektronegatives „oder elektronenliebendes“ Atom im Vergleich zu Wasserstoff.
Wasser ist ein „polares“ Molekül, was bedeutet, dass es eine ungleichmäßige Verteilung der Elektronendichte gibt. Wasser hat eine teilweise negative Ladung ( Eine elektrostatische Anziehung zwischen der partiellen positiven Ladung in der Nähe der Wasserstoffatome und der partiellen negativen Ladung in der Nähe des Sauerstoffs führt zur Bildung einer Wasserstoffbindung, wie in der Abbildung gezeigt. |
 |
Die Fähigkeit von Ionen und anderen Molekülen, sich in Wasser aufzulösen, ist aufgrund der Polarität. Beispielsweise wird in der folgenden Abbildung Natriumchlorid in seiner kristallinen Form gezeigt und in Wasser gelöst.,
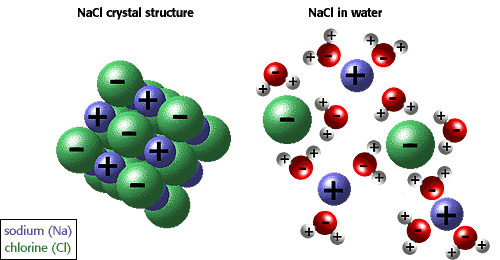
Viele andere einzigartige Eigenschaften von Wasser sind wegen der Wasserstoffbrücken. Zum Beispiel schwimmt Eis, weil Wasserstoffbrücken Wassermoleküle haltenweiter auseinander in einem Feststoff als in einer Flüssigkeit, wo es eine weniger Wasserstoffbindung pro Molekül gibt. Die einzigartigen physikalischen Eigenschaften, einschließlich einer hohen Verdampfungswärme, einer starken Oberflächenspannung, einer hohen spezifischen Wärme und nahezu universellen Lösungsmitteleigenschaften von Wasser, sind auch auf die Wasserstoffbindung zurückzuführen., Der hydrophobe Effekt oder der Ausschluss von Verbindungen enthaltenkohlenstoff und Wasserstoff (unpolare Verbindungen) ist eine weitere einzigartige Eigenschaft von Wasser, die durch die Wasserstoffbrücken verursacht wird. Die hydrophobe Wirkung ist besonderswichtig bei der Bildung von Zellmembranen. Die beste Beschreibung ist zu sagen, dass Wasser unpolare Moleküle „zusammendrückt“.,
Säuren und Basen, Ionisation von Wasser
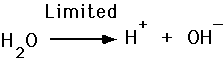
- Säurefreisetzung H+
- Basen akzeptieren H+
Wir definieren den pH-Wert einer Lösung als negativen Logarithmus der Wasserstoffionenkonzentration.
- bei pH 7.,0, a solution is neutral
- at lower pH (1-6), a solution is acidic
- at higher pH (8-14), a solution is basic
![]()
![]()




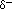 ) in der Nähe des Sauerstoffatoms aufgrund der nicht geteilten Elektronenpaare und teilweise positive Ladungen (
) in der Nähe des Sauerstoffatoms aufgrund der nicht geteilten Elektronenpaare und teilweise positive Ladungen ( ) in der Nähe der Wasserstoffatome.,
) in der Nähe der Wasserstoffatome.,