Kemi handledning
Kemi vatten
polariteten av vatten
| vatten har en enkel molekylstruktur. Den består av en syreatom och två väteatomer. Varje väteatom är kovalent bunden till syret via ett delat par elektroner. Syre har också två oskadade par elektroner. Således finns det 4 par elektroner som omger syreatomen, två par som är involverade i kovalenta bindningar med väte och två oskadade par på motsatt sida av syreatomen., Syre är en ” elektronegativ ”eller elektron” kärleksfull ” atom jämfört med väte.
vatten är en ”polär” molekyl, vilket innebär att det finns en ojämn fördelning av elektrondensitet. Vatten har en partiell negativ laddning ( en elektrostatisk attraktion mellan den partiella positiva laddningen nära väteatomerna och den partiella negativa laddningen nära syre resulterar i bildandet av en vätebindning som visas i illustrationen. |
 |
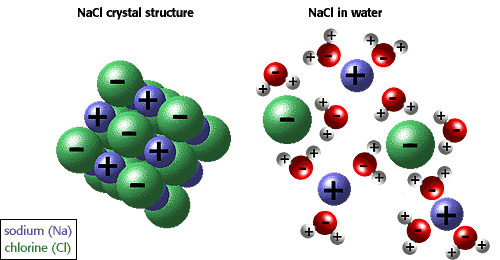
förmågan hos joner och andra molekyler att lösa upp i vatten beror på polaritet. Till exempel visas i illustrationen nedan natriumklorid i sin kristallina form och löses i vatten.,
många andra unika egenskaper hos vatten beror på vätebindningarna. Till exempel flyter is eftersom vätebindningar håller vattenmolekylervidare ifrån varandra i en fast substans än i en vätska, där det finns en mindre vätebindning per molekyl. De unika fysikaliska egenskaperna, inklusive en hög värme av förångning, stark ytspänning, hög specifik värme och nästan universella lösningsegenskaper hos vatten beror också på vätebindning., Den hydrofoba effekten, eller uteslutningen av föreningar som innehållerkol och väte (icke-polära föreningar) är en annan unik egenskap hos vatten som orsakas av vätebindningarna. Den hydrofoba effekten är särskiltviktigt i bildandet av cellmembran. Den bästa beskrivningen är att säga att vatten ”klämmer” icke-polära molekyler tillsammans.,
syror och baser, jonisering av vatten
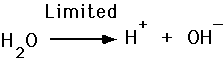
- syrafrisättning H+
- baser accepterar H+
Vi definierar pH för en lösning som den negativa logaritmen för vätejonkoncentrationen.
- vid pH 7.,0, a solution is neutral
- at lower pH (1-6), a solution is acidic
- at higher pH (8-14), a solution is basic
![]()
![]()




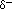 ) nära syreatomen på grund av de oskadade paren av elektroner och partiella positiva laddningar (
) nära syreatomen på grund av de oskadade paren av elektroner och partiella positiva laddningar ( ) nära väteatomerna.,
) nära väteatomerna.,