Kjemi Opplæringen
Kjemi Vann
polaritet av vann
| Vann har en enkel molekylær struktur. Det består av ett oksygen atom og to hydrogen atomer. Hver hydrogenatom er covalently bundet til oksygen via en delt par av elektroner. Oksygen har også to unshared par av elektroner. Dermed er det 4 par av elektroner rundt oksygen atom, to par som er involvert i covalent obligasjoner med hydrogen, og to unshared par på motsatt side av oksygen atom., Oksygen er en «electronegative» eller elektron «kjærlig» atom sammenlignet med hydrogen.
Vann er en «polar» molekyl, noe som betyr at det er en ujevn fordeling av elektron tetthet. Vann har en delvis negativ ladning ( En elektrostatisk tiltrekning mellom de delvis positiv ladning i nærheten av hydrogen atomer og delvis negativ ladning i nærheten av oksygen resulterer i dannelsen av en hydrogen bond som vist i illustrasjonen. |
 |
evne til ioner og andre molekyler til å oppløse i vann er på grunn av polaritet. For eksempel, i illustrasjonen nedenfor natriumklorid er vist i sin krystallinsk form og oppløst i vann.,
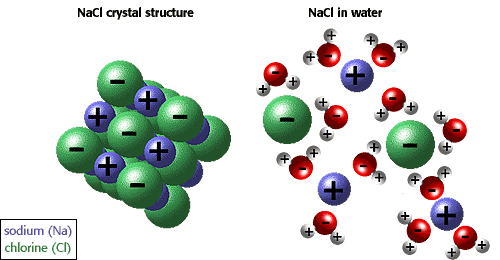
Mange andre unike egenskaper til vann er på grunn av hydrogen obligasjoner. For eksempel, is flyter fordi hydrogen obligasjoner holde vann moleculesfurther fra hverandre i en solid enn i flytende form, der det er en mindre hydrogen bond per molekyl. Unike fysiske egenskaper, inkludert en høy varme av dampfunksjon, sterk overflate spenning, høy spesifikk varme, og nesten universell solvent egenskaper av waterare også på grunn av hydrogen binding., Den hydrofobe effekt, eller utelukkelse av forbindelser containingcarbon og hydrogen (upolare forbindelser) er en annen unik egenskap av vann forårsaket av hydrogen obligasjoner. Den hydrofobe effekten er particularlyimportant i dannelsen av cellemembraner. Den beste beskrivelsen er å si at vann «klemmer» upolare molekyler sammen.,
Syrer og Baser, Ionisering av Vann
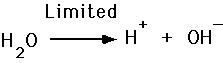
- Syre slipper H+
- Baser godta H+
Vi definerer pH i en løsning som den negative logaritmen av hydrogen ion konsentrasjon.
- ved pH 7.,0, a solution is neutral
- at lower pH (1-6), a solution is acidic
- at higher pH (8-14), a solution is basic
![]()
![]()




 ) i nærheten av oksygen atom grunn unshared par av elektroner, og delvis positive ladninger (
) i nærheten av oksygen atom grunn unshared par av elektroner, og delvis positive ladninger ( ) i nærheten av hydrogen atomer.,
) i nærheten av hydrogen atomer.,