Kemi Tutorial
Kemien i Vandet
polaritet af vand
| Vand har en enkel molekylære struktur. Det består af et O oxygenygenatom og to hydrogenatomer. Hvert hydrogenatom er kovalent bundet til O .ygen via et delt par elektroner. O .ygen har også to ikke-delte par elektroner. Således er der 4 par elektroner, der omgiver o .ygenatomet, to par involveret i kovalente bindinger med hydrogen og to ikke-delte par på den modsatte side af O .ygenatomet., O .ygen er et” elektronegativt “eller elektron” kærligt ” atom sammenlignet med hydrogen.
vand er et” polært ” molekyle, hvilket betyder, at der er en ujævn fordeling af elektrondensitet. Vand har en delvis negativ ladning ( en elektrostatisk tiltrækning mellem den partielle positive ladning nær hydrogenatomerne og den partielle negative ladning nær O .ygenet resulterer i dannelsen af en hydrogenbinding som vist på illustrationen. |
 |
ions og andre molekylers evne til at opløses i vand skyldes polaritet. For eksempel i illustrationen nedenfor er natriumchlorid vist i sin krystallinske form og opløst i vand.,
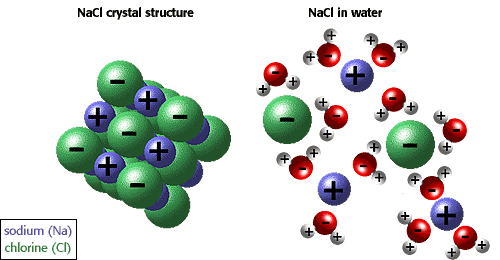
mange andre unikke egenskaber ved vand skyldes hydrogenbindingerne. For eksempel flyder is, fordi hydrogenbindinger holder vandmolekyleryderligere fra hinanden i et fast stof end i en væske, hvor der er en mindre hydrogenbinding pr.molekyle. De unikke fysiske egenskaber, herunder en høj fordampningsvarme, stærk overfladespænding, høj specifik varme og næsten universelle opløsningsmiddelegenskaber af vandskyldes også hydrogenbinding., Den hydrofobe virkning eller udelukkelsen af forbindelser indeholdendekulstof og hydrogen (ikke-polære forbindelser) er en anden unik egenskab af vand forårsaget af hydrogenbindingerne. Den hydrofobe effekt er særligvigtigt i dannelsen af cellemembraner. Den bedste beskrivelse er at sige, at vand “klemmer” ikke-polære molekyler sammen.,
Syrer og Baser, Ionisering af Vand
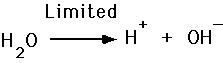
- Syre frigøre H+
- Baser acceptere H+
Vi definere pH i en opløsning som den negative logaritme af hydrogen ion koncentration.
- ved pH 7.,0, a solution is neutral
- at lower pH (1-6), a solution is acidic
- at higher pH (8-14), a solution is basic
![]()
![]()




 ) nær O .ygenatomet på grund af de ikke-delte par elektroner og partielle positive ladninger (
) nær O .ygenatomet på grund af de ikke-delte par elektroner og partielle positive ladninger ( ) nær hydrogenatomerne.,
) nær hydrogenatomerne.,