Affiliate Disclosure: ik ontvang een kleine commissie voor aankopen gedaan via affiliate links.in het midden van het onderwijzen van een aantal middelbare scholieren over de chemie van zeep maken, realiseerde ik me dat ik echt, echt wilde proberen zelf wat zeep te maken en hier over te schrijven. Mijn write-up eindigde als echt lang, dus ik heb het gemaakt een twee – parter-aflevering 1 is alles over de chemie, en aflevering 2 is over de werkelijke procedure (die je ook thuis kunt doen met apparatuur en chemicaliën uit de supermarkt!).,

u hoeft de chemie achter het maken van zeep niet te begrijpen om zeep te maken, maar het kennen van de achtergrond betekent wel dat u kunt spelen met uw recepten en problemen kunt oplossen die u tegenkomt met minimale trial-and-error en verspilling! Het is ook heel interessant vanuit wetenschappelijk oogpunt.
Jump to section:
- Wat is Soap?,
- Zeep Maken-de Verzepingsreactie
- vetten en oliën
- sterke Base
- verhoudingen
- glycerine
- samenvatting
voordat we kunnen beginnen met de nitty gritty van chemische reacties – Wat is zeep?
Wat is Soap?
als je me al een tijdje volgt, herinner je je dat ik chemicaliën noemde die oppervlakteactieve stoffen worden genoemd, zoals in mijn gastartikel over chemophobia on the Toast, en in deze gids voor het wassen van gezichten., Oppervlakteactieve stoffen zijn handige moleculen die oplossen in zowel water-als olie-gebaseerde stoffen, wat betekent dat ze olie kunnen reinigen van oppervlakken, en houden mengsels van olie en water gebaseerde vloeistoffen gelukkig samen (denk mayonaise – zonder eigeel fungeren als een oppervlakteactieve stof houden alles gemengd, het zou gewoon scheiden in vinagrette dressing).
oppervlakteactieve stoffen hebben een geladen waterminnende, hydrofiele ” kop “en een neutrale, olieminnende, lipofiele”staart”.
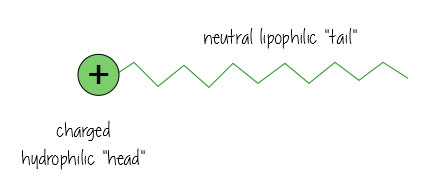
zo ziet het eruit als het olie oplost in water (bijv., in uw vuile badwater, of het houden van het vet opgelost in uw melk) – de oppervlakteactieve stoffen hangen in het raakvlak tussen de olie en het water, het houden van alles bij elkaar.
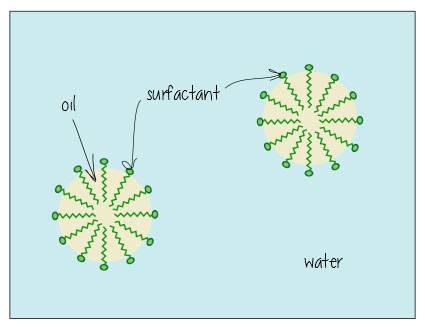
Zeep er als volgt uitzien:
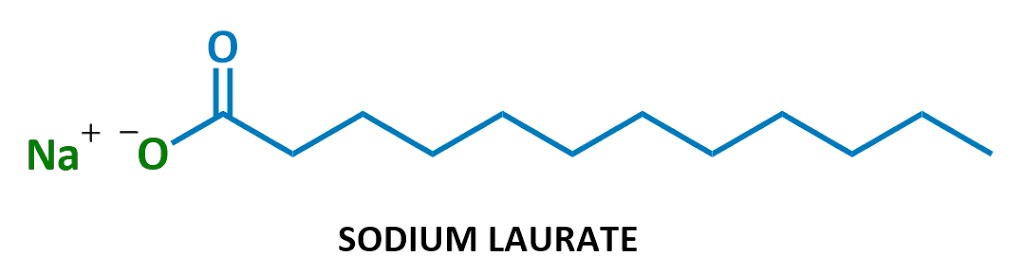
Deze bijzondere zeep molecuul heet laurate, sodium. Als het in water oplost, splitsen het natrium (Na+ links) en het lauraat (de rest van het diagram) zich op., Hier is het lauraat ion:
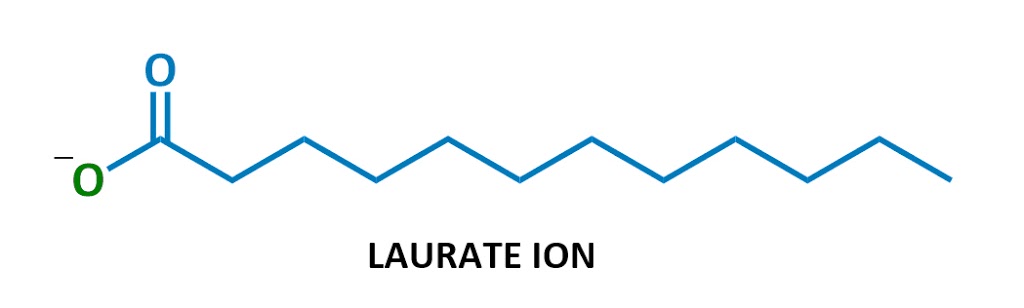
ziet er bekend uit?

Yep, zeep is negatief geladen oppervlakteactieve stoffen! Ze maken deel uit van een klasse van chemicaliën genaamd anionische oppervlakteactieve stoffen (anionisch = negatief geladen), die de sterkste reinigingsmiddelen omvat. (Technisch worden zepen aangeduid als” zouten van vetzuren ” – Ik zal deze terminologie niet veel gebruiken, maar het is hier voor het geval je het ooit nodig hebt.)
dus, hoe krijgen we deze nuttige dingen in onze smerige kleine handjes?,
Zeep Maken-de Verzepingsreactie
zeep wordt gemaakt van een reactie van een vet of olie (of een mengsel) met een sterke base (iets met een zeer hoge pH). De chemische structuren van vetten en oliën zien er over het algemeen als volgt uit:
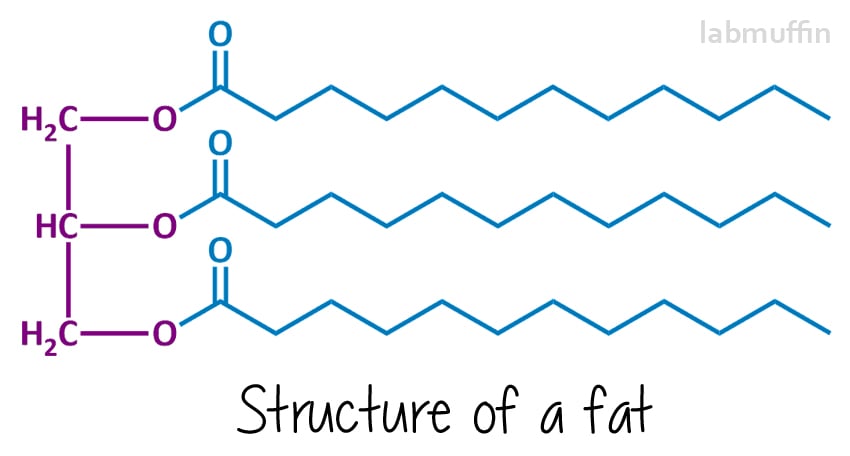
de linkerkant (paars) is altijd hetzelfde – het is gebaseerd op een glycerolmolecuul. Elke ” O ” vertegenwoordigt een zuurstofatoom – er zijn er 3 op glycerol, en deze zijn chemisch bevestigd aan 3 vetzuren (in blauw, wat uiteindelijk de zeep zal zijn)., Deze kunnen allemaal hetzelfde of anders zijn (in deze tekening heb ik ze allemaal hetzelfde getekend). Want er zijn drie dingen en ze zijn verbonden met een glycerine molecuul, vetten en oliën worden triglyceriden genoemd.
De zeepvormende reactie wordt verzeping genoemd, en na de reactie wordt gezegd dat het mengsel verzept is. Verzeping omvat het reageren van het vet of de olie met een sterke base, meestal natriumhydroxide (aka loog aka bijtende soda), hoewel u ook kaliumhydroxide (aka bijtende potas) kunt gebruiken., Deze reactie breekt de triglyceride in de paarse en blauwe delen, met andere woorden, de glycerine-en zeepmoleculen.
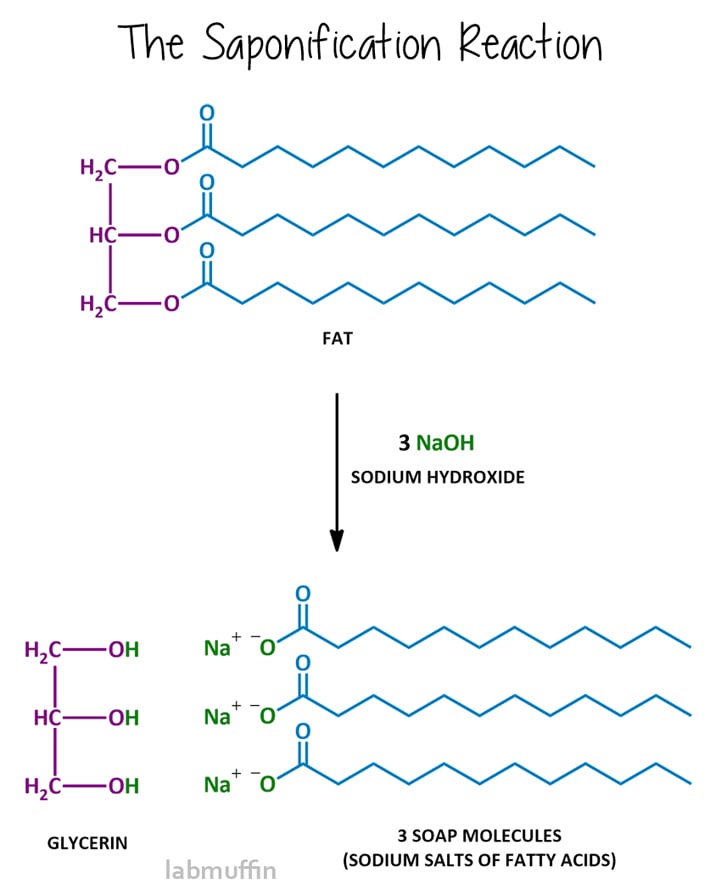
laten we eens kijken naar elk onderdeel van de reactie:
vetten en oliën
Dit is het meest ingewikkelde en interessante deel van het recept. Verschillende vetten en oliën kunnen worden gebruikt om zepen met verschillende eigenschappen te maken. In vetten en oliën, de vetzuren (dat is het blauwe deel, vergeet niet) verschillen.
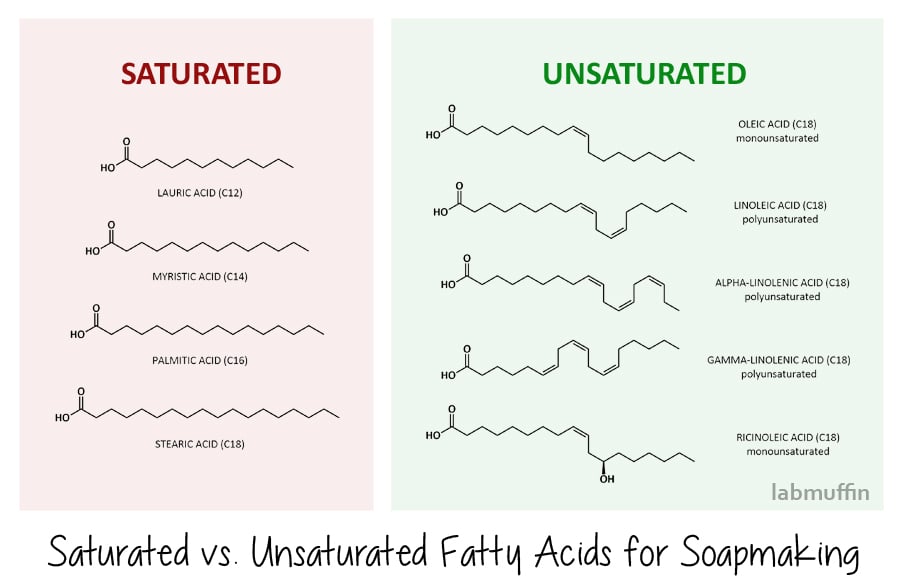
Er zijn twee hoofdtypen vetzuren: verzadigd en onverzadigd., (Dit is hetzelfde als de verzadigde en onverzadigde vetten waar je over hoort van diëtisten!)
verzadigde vetzuren hebben een eenvoudige zig-zag in hun structuur. De meest voorkomende die we gebruiken bij het maken van zeep zijn laurinezuur, myristinezuur, palmitinezuur en stearinezuur, hieronder weergegeven. Dit betekent dat wanneer ze netjes op moleculair niveau stapelen, zowel voor als na verzeping, hardere zepen vormen (en hardere verstoppingen in je slagaders, als je ze eet)., Zepen gemaakt van verzadigde vetzuren zijn ook effectiever bij het reinigen – dit betekent echter dat ze ook meer natuurlijke olie van uw huid verwijderen.
klik op de afbeelding om een grotere versie te bekijken
onverzadigde vetzuren hebben knikjes in hun structuur, vanwege dubbele bindingen (de bits waar de zig zag twee parallelle lijnen wordt)., Veel voorkomende onverzadigde vetzuren die worden gebruikt bij het maken van zeep zijn oliezuur, linolzuur, alfa-en gamma – linoleenzuur (deze zijn ook bekend als omega-vetzuren – nogmaals, iets wat je eerder bent tegengekomen in de context van voeding), en ricinolzuur. Vanwege hun kinky vorm stapelen ze niet netjes op moleculair niveau en kunnen ze met veel gaten rondschuiven, wat betekent dat je eindigt met zachtere zeepstaven (en ze verstoppen de slagaders niet als je ze eet). Zepen gemaakt van onverzadigde vetzuren zijn minder efficiënt bij het reinigen en zijn daardoor zachter voor de huid.,
niet alleen de hardheid van uw zeep en de reinigende werking ervan, ook de hoeveelheid van elk verzeept vetzuur in de uiteindelijke zeep zal van invloed zijn op hoe het schuim zich gedraagt. Over het algemeen geven verzadigde vetzuren je een romig, stabiel schuim, terwijl onverzadigde vetzuren resulteren in een pluizig maar onstabiel schuim. Een opmerkelijke uitzondering is echter ricinolzuur (gevonden in ricinusolie), dat onverzadigd is maar een rijk, pluizig schuim geeft dat ook vrij stabiel is. Onverzadigde vetzuren hebben ook de neiging om ranzig te gaan gemakkelijker, als de dubbele binding kan reageren.,
(opmerking: dierlijke en plantaardige vetten en oliën zijn triglyceriden – minerale olie en andere oliën uit aardolie zijn daarentegen geen triglyceriden, dus het is onmogelijk om er zeep van te maken.)
u kunt ook gemakkelijk de vetzuurprofielen van gewone vetten en oliën opzoeken – ze zullen per batch olie verschillen, dus het zijn echt cijfers., Hier zijn de drie oliën die Ik zal gebruiken in het project (info van deze geweldige zeepcalculator):
Strong Base
de basen die gebruikt worden voor het zeepmaken moeten hydroxide bevatten – dat is het bit dat werkt om het vet of de olie te breken in glycerine en zeep. Natriumhydroxide en kaliumhydroxide zijn de 2 meest gebruikte basen voor verzeping.
natriumhydroxide (ook bekend als loog of bijtende soda) wordt het meest gebruikt, en resulteert in een harde bar. Kaliumhydroxide resulteert in een zachte bar, en wordt meestal gebruikt voor het maken van vloeibare zeep., De reden voor het verschil is dat het natriumion een beetje kleiner is dan het kaliumion – het interfereert minder met het stapelen van de zeepmoleculen op moleculair niveau, en net als bij verzadigde vs.onverzadigde vetzuren hierboven, hoe efficiënter het stapelen, hoe harder de resulterende zeep.
veiligheid opmerking: sterke basen zijn nogal vervelende dingen om mee te spelen – net als sterke zuren, zullen ze je huid direct wegbranden. Herinner je je de scène van Fight Club? Het is niet alleen artistieke licentie-je zal eindigen met een permanent litteken!, Ik zal meer ingaan op de veiligheidsoverwegingen voor het maken van zeep in de volgende post.
verhoudingen
in het reactiediagram hierboven zult u zien dat u 3 basisdeeltjes nodig hebt om te reageren met één vet-of oliedeeltje. Moleculen zijn belachelijk klein, dus we kunnen niet zitten en het exacte aantal tellen dat we in onze pan moeten mengen. Degenen onder jullie die scheikunde hebben bestudeerd zullen weten dat er een methode is voor het berekenen van de verhoudingen van componenten, maar vetten en oliën hebben de neiging om mengsels van vetzuren te bevatten in plaats van een enkel soort molecuul, dus het is geen eenvoudige taak!,
gelukkig zijn er veel zeeprekenmachines en verzepingstabellen online met voorgeprogrammeerde getallen die het vuile werk voor ons kunnen doen – hier zijn er een paar. (Als je een bijzonder geavanceerde zeepcalculator gebruikt, zal het ook de voorspelde eigenschappen berekenen van de zeep gemaakt van welk mengsel van vetten en oliën je hebt gekozen, alleen uit het %s van elk vetzuur, wat echt handig is.,)
deze rekenmachines laten ons uitzoeken wat de perfecte verhoudingen zouden zijn, maar vergeet niet dat we geen super precieze wetenschappelijke instrumenten gebruiken – we gebruiken keukenschalen, die behoorlijk wat moleculen zullen afwegen (en met nogal wat bedoel ik in de regio van 2.500.000.000.000.000.000.000.000.000.000 – dat is het aantal NaOH deeltjes in een miezerige gram). Als we niet genoeg base hebben, zal er te veel vet/olie overblijven aan het einde – slapend vet op je huid klinkt niet erg reinigend!, Aan de andere kant, als we niet genoeg vet/olie hebben, hebben we sterke base over aan het einde in de zeep bar – au!
de manier waarop we het veilig spelen is door superfatteren, wat betekent dat we iets minder hydroxide toevoegen dan we nodig hebben – genoeg om veilig te zijn, maar niet zozeer dat de zeep te vet wordt. Dit wordt ook wel een loog korting, en is meestal rond 5-8%.
glycerine
Dit is het product dat bij alle verzepingsreacties hetzelfde is., Glycerine is een bevochtigingsmiddel, wat betekent dat het water naar de huid trekt om vocht toe te voegen (Het is het spul dat deze DIY nagellak remover zo voedend maakt!). Echter, dit betekent ook dat het trekt water naar uw laatste stuk zeep, waardoor het draaien om brij als je niet voorzichtig bent. Commercieel geproduceerde zepen verwijderen meestal veel van de glycerine om dit probleem te omzeilen, en sommige handgemaakte zepen ook (met behulp van een proces genaamd “zouten uit”), maar dit is een beetje geavanceerder dan we nodig hebben voor dit project.,
samenvatting
- zepen zijn oppervlakteactieve stoffen, wat betekent dat ze oplossen in water en olie en kunnen reinigen.
- Zeepmaken houdt in dat vetten/oliën reageren met een sterke hydroxidebasis, waardoor glycerine en zeep (vetzuren) worden gevormd.
- vet/oliemoleculen (triglyceriden) bestaan uit glycerine die chemisch aan 3 vetzuren is bevestigd.
- de specifieke vetzuren in de vetten/oliën die u reageert zullen de eigenschappen van uw laatste stuk zeep bepalen.,
- de sterke hydroxidebasis die u gebruikt om een stuk zeep te maken, zal waarschijnlijk natriumhydroxide zijn, met een hoge pH
- om te berekenen hoeveel van elke chemische stof u nodig hebt in uw reactie, moet u een zeepcalculator of verzepingstabel gebruiken.
- u wilt een beetje overtollig vet/olie (5-8%) in uw recept, want een beetje vet (gehydrateerd) is beter dan je huid afbranden! Dit heet superfatting.
dat is de chemie achter zeepmaken in een (vrij grote) notendop., Maar hoe gaan we van dit naar … eigenlijk een stuk zeep hebben om op je lichaam te gebruiken? Deel 2 gaat over het proces-tot dan!

