voorbeeld 2.5.1: Multiple Resonance of other moleculen
moleculen with more than one resonance form
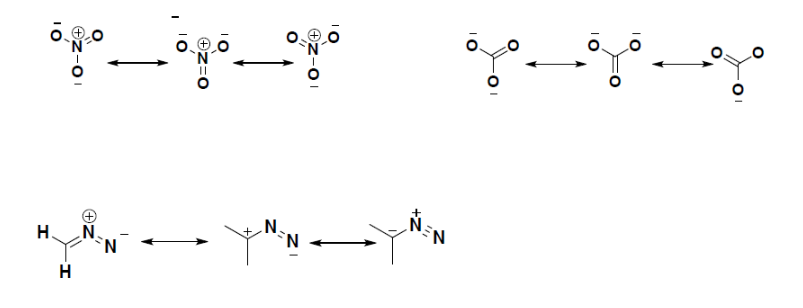
sommige structurele resonantieconformaties zijn de belangrijkste bijdrager of de dominante vormen dat het molecuul bestaat. Bijvoorbeeld, als we kijken naar de bovenstaande regels voor het schatten van de stabiliteit van een molecuul, zien we dat Voor de derde molecule de eerste en tweede vormen zijn de belangrijkste bijdragen aan de algehele stabiliteit van de molecule., De stikstof is meer elektronegatief dan koolstof zodat, kan het de negatieve last meer dan koolstof behandelen. Een koolstof met een negatieve lading is de minst gunstige bouw voor de molecule om te bestaan, zodat draagt de laatste resonantievorm zeer weinig voor de stabiliteit van het Ion.
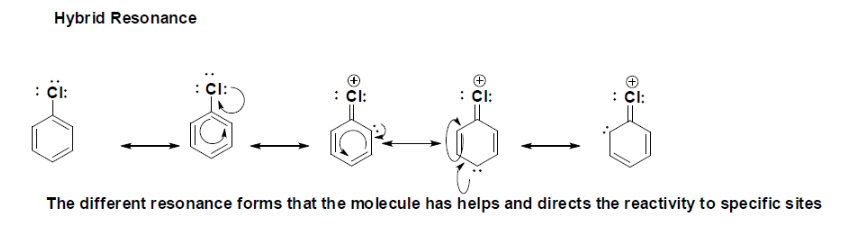
De hybride Resonantievormen tonen de verschillende Lewis-structuren met het elektron gedelokaliseerd., Dit is zeer belangrijk voor de reactiviteit van chloor-benzeen omdat het in aanwezigheid van een elektrofiel zal reageren en de vorming van een andere binding zal worden gestuurd en bepaald door resonantie. Het lange paar elektronen dat in de aromatische gesubstitueerde ring wordt gedelokaliseerd, is waar het potentieel een nieuwe binding met een elektrofiel kan vormen, aangezien er drie mogelijke plaatsen zijn waar reactiviteit kan plaatsvinden, de eerste die reageert zal plaatsvinden op de para positie ten opzichte van de chloorsubstituent en vervolgens op beide ortho positie.