Homonuclear Diatomic Molekyler
I atomer, som du vet, elektroner bor i orbitals av ulike energylevels som 1s, 2s, 3d, etc.Disse orbitals representerer sannsynlighetsfordeling for å finne anelectron hvor som helst rundt theatom. Molecular orbital teori har den oppfatningen at elektroner inmolecules likeledes finnes likegyldig orbitals som gir sannsynligheten for å finne elektronet atparticular poeng rundt themolecule., For å produsere sett av orbitals for et molekyl, vi addtogether de valence atomicwavefunctions for bundet atomer i molekylet. Dette er ikke så komplisert som det kan høres. La oss vurdere bonding inhomonuclear diatomicmolecules–molekyler av formelen A2.
Kanskje den enkleste molekyl vi kan forestille deg er hydrogen, H2.Som vi havediscussed, for å produsere den molekylære orbitals for hydrogen, vil vi legge til togetherthe valence atomicwavefunctions å produsere den molekylære orbitals for hydrogen. Eachhydrogen atom inH2 har bare 1s orbital, så legger vi de to 1swavefunctions., Som du havelearned i ditt studium av atom-strukturen, atomic wavefunctions kan haveeither pluss eller minusphases–dette betyr at verdien av wavefunction yis enten positive ornegative. Det er to måter å legge til det wavefunctions, eitherboth i-fase (enten bothplus eller begge minus) eller ut-av-fase (one plus og andre minus).viser hvordan atomic wavefunctions kan legges sammen for å produsere molecularorbitals.
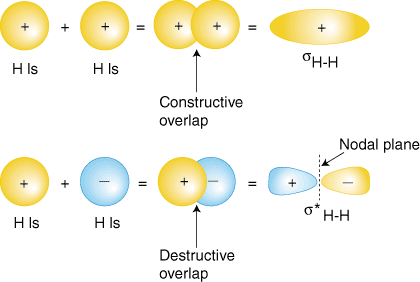
i-fase overlapper kombinasjon (øverst sett av orbitals i ) produserer bygge opp electron tetthet mellom de to kjerner som resulterer i alower energi for at orbital.Elektronene opptar sH-Horbital representerer thebonding par av elektroner fra Lewis struktur av H2 andis treffende navnet abonding molecular orbital. Den andre molecular orbital produsert, s*H-H viser en nedgang i electron densitybetween den nucleireaching en null-verdi på midtpunktet mellom kjerner hvor det isa-nodal flyet., Siden s*H-H-orbital viser en nedgang i bondingbetween den twonuclei, det kalles en antibonding molecular orbital. På grunn av thedecrease i electron densitybetween den kjerner, antibonding orbital er høyere energi enn boththe bonding orbital og thehydrogen 1s orbitals. I molekylet, H2, ingen elektroner okkupere antibonding orbital.,
for Å oppsummere disse funnene om den relative energier av liming,antibonding, og atomicorbitals, kan vi konstruere en orbital korrelasjon diagram, shownin :
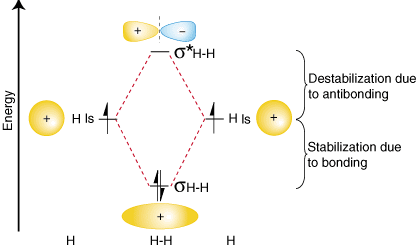
legg Merke til at orbitals av separert atomer er skrevet på enten sideof diagrammet som horizontallines på høyder som betegner deres relative energier. Elektronene i eachatomic orbital er representedby piler., I midten av diagrammet, den molekylære orbitals av themolecule av interesse arewritten. Stiplede linjer koble den overordnede atomic orbitals med daughtermolecular orbitals. Ingeneral, bonding molekylær orbitals er lavere energi enn enten oftheir overordnede atomic orbitals.På samme måte, antibonding orbitals er høyere energi enn noen av itsparent atomic orbitals. Becausewe må adlyde loven om bevaring av energi, mengden av stabilizationof bonding orbitalmust lik mengden av destabilisering av antibonding orbital, som shownabove.,
lurer Du kanskje på om Lewis struktur og molekylær orbitaltreatment av hydrogen moleculeagree med hverandre. Faktisk, de gjøre. Lewis struktur forH2 er H-H, predictinga enkelt bånd mellom hver hydrogenatom med to elektroner i obligasjonsmarkedet.Orbital correlationdiagram i forutsier det samme–to electronsfill en enkelt bondingmolecular orbital. For ytterligere å demonstrere konsistensen av Lewisstructures med M. O. teori,vi vil formalisere en definisjon av bond order–antall bondsbetween atomene i et molekyl.,Obligasjonslånet rekkefølge er forskjellen i antall elektron par occupyingan antibonding og abonding molecular orbital. Fordi hydrogen har ett elektron pairin sin liming orbital andnone i sin antibonding orbital, molecular orbital teori forutsier at H2 har en bondorder av en–det samme resultatet som er avledet fra Lewis strukturer.