Affiliate Disclosure: jeg får en liten provisjon for kjøp som gjøres via affiliate linker.
I midten av undervisning i noen high school-elever om kjemi såpe-å, jeg innså at jeg virkelig, virkelig lyst til å prøve å lage noen såpe meg selv og skrive om det her. Min write-up endte opp med å bli veldig lang, så jeg har gjort det en to-arvinger – Utgaven 1 handler om kjemi, og Avdrag 2 er om selve prosedyren (som du også kan gjøre hjemme med utstyr og kjemikalier fra supermarkedet!).,

Du trenger ikke å forstå kjemien bak såpe gjør for å lage såpe, men å vite bakgrunnen betyr at du kan leke deg med oppskrifter og løser alle problemer du kjøre inn med minimal prøve-og-feile og svinn! Det er også svært interessant fra et vitenskapelig synspunkt.
gå til avsnittet section:
- Hva Er Såpe?,
- for å Lage Såpe – Det Forsåpning Reaksjon
- Fettstoffer og Oljer
- Sterk Base
- Proporsjoner
- Glyserin
- Oppsummering
Før vi kan starte med nitty gritty av kjemiske reaksjoner – hva er såpe?
Hva Er Såpe?
Hvis du har fulgt meg en stund, vil du huske meg å nevne kjemikalier kalles overflateaktive stoffer, slik som i min gjest innlegg på chemophobia på Toast, og i dette ansikt vask guide., Tensider er kjekk molekyler som løser seg opp i både vann – og olje-basert stoffer, noe som betyr at de kan ren olje av overflater, og holde blandinger av olje-og vannbaserte væsker lykkelig sammen (tror majones uten egg eggeplomme opptrer som et overflateaktivt middel for å holde alt blandet, det vil bare skille i vinagrette dressing).
Tensider har en ladet vann-elskende, hydrofile «hodet», og en nøytral, olje-kjærlig, lipofile «hale».
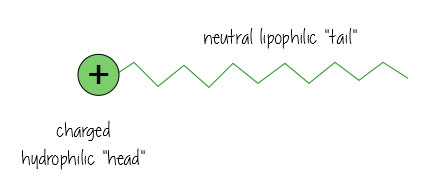
Her er hvordan det ser ut når det er oppløsning olje i vann (f.eks., i din skitne bathwater, eller å holde fett oppløst i melk) – den tensider henge ut i grensesnittet mellom olje og vann, som holder alt sammen.
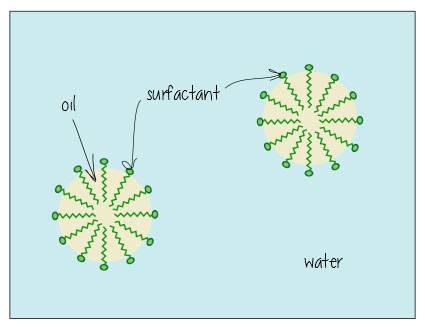
Såper se noe som dette:
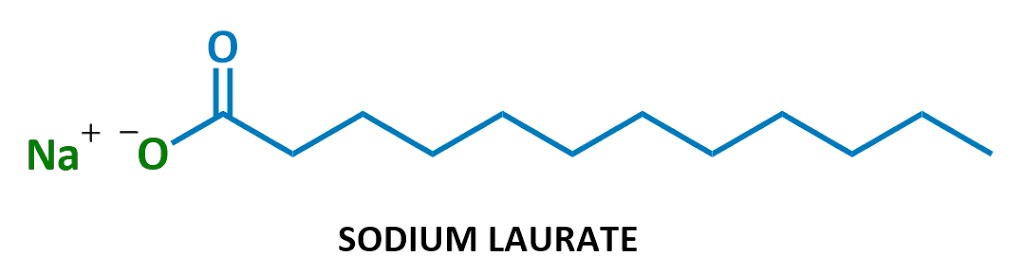
Dette bestemte såpe molekyl kalles sodium laurate. Når den løses i vann, natrium (Na+ på venstre) og laurate (resten av diagrammet) splittet opp., Her er laurate ion:
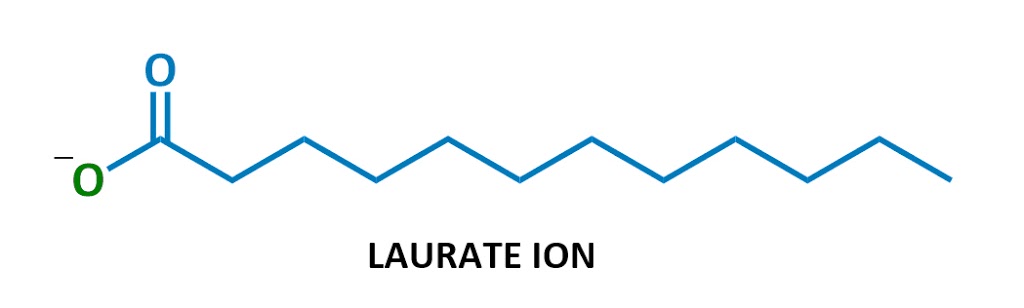
Ser kjent ut?

Jepp, såper er negativt ladet overflateaktive stoffer! De er en del av en klasse av kjemikalier kalles anioniske tensider (anioniske = negativt ladet), som har den sterkeste rengjøringsmidler. (Teknisk såper er referert til som «salter av fettsyrer» – jeg vil ikke bruke denne terminologien mye, men det er her i tilfelle du trenger det.)
Så, hvordan kan vi få disse nyttige ting i vår skittent små hender?,
å Lage Såpe – Det Forsåpning Reaksjon
Såpe er laget fra reagerer fett eller olje (eller en blanding) med en sterk base (noe med svært høy pH). Den kjemiske strukturer av fettstoffer og oljer vanligvis ser ut som dette:
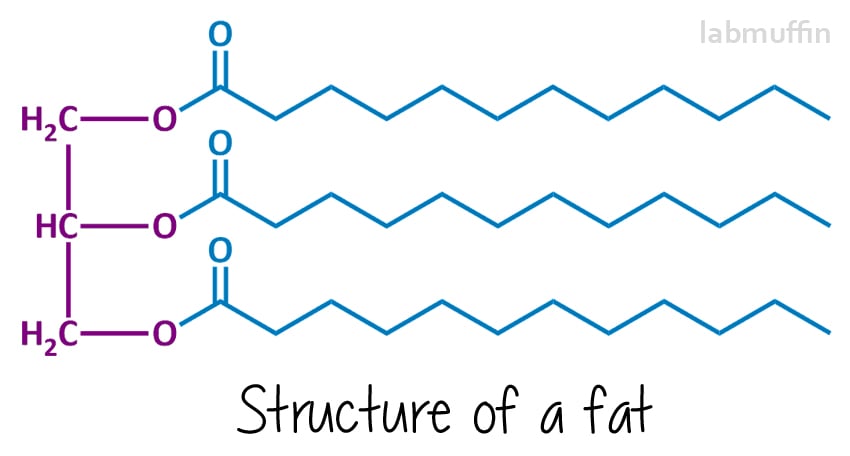
venstre side (lilla) er alltid det samme – det er basert på en glyserin (aka glyserol) molekyl. Hver «O» representerer et oksygen atom – det er 3 på glyserol, og disse er kjemisk knyttet til 3-fettsyrer (i blått, som vil ende opp som såpe)., Disse kan alle være den samme eller ulike (i denne tegningen, jeg har trukket dem alle det samme). Fordi det er tre ting, og de er koblet til et glyserin-molekylet, fettstoffer og oljer er kalt triglyserider.
soapmaking reaksjon kalles forsåpning, og etter å reagere, blandingen er sagt å være saponified. Forsåpning innebærer reagerer fett eller olje med en sterk base, vanligvis natriumhydroksid (aka lye aka kaustisk soda), men du kan også bruke kaliumhydroksid (aka kaustisk pottaske)., Denne reaksjonen bryter triglyserid i lilla og blå delene, med andre ord, glyserin og såpe molekyler.
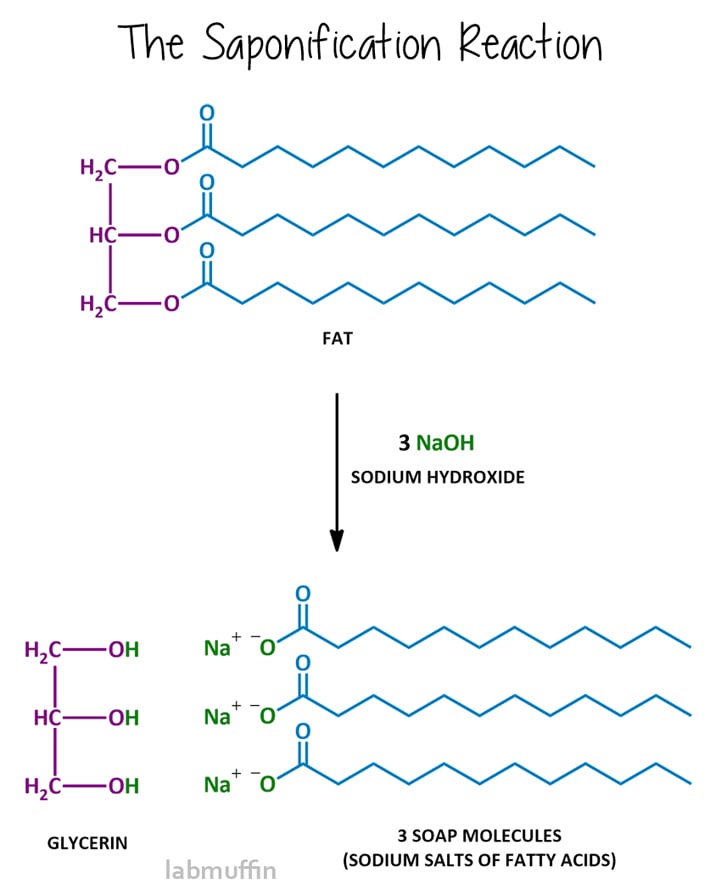
La oss ta en nærmere titt på hver enkelt komponent av reaksjonen:
Fettstoffer og Oljer
Dette er den mest kompliserte og interessante del av oppskriften. Forskjellige fettstoffer og oljer kan brukes til å lage såper med ulike egenskaper. I fettstoffer og oljer, fettsyrer (som er blå delen, må du huske) forskjellige.
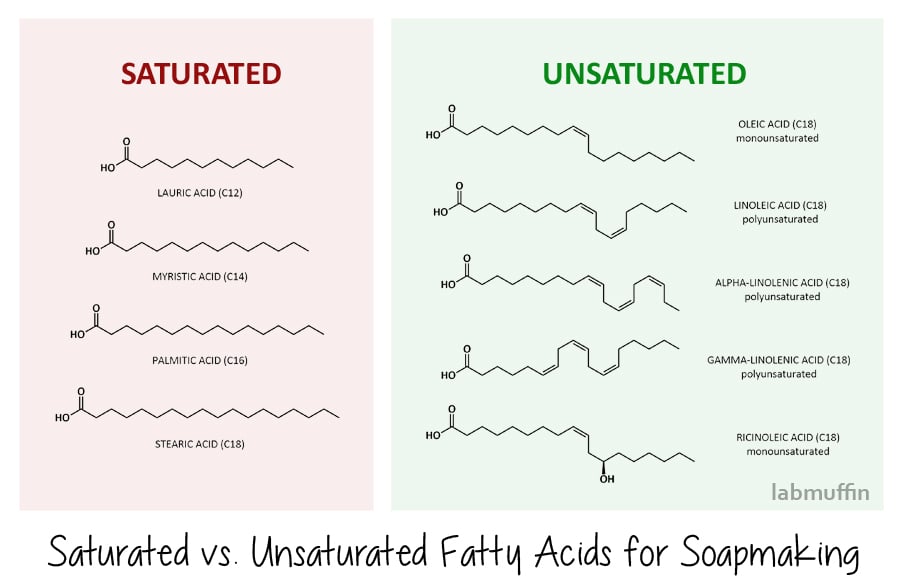
Det er i hovedsak to typer fettsyrer: mettet og umettet., (Dette er det samme som mettet og umettet fett som du hører om fra kliniske ernæringsfysiologer!)
Mettede fettsyrer har en grei sikksakk i sin struktur. Den vanlige bruker vi i såpe-gjør er lauric syre, myristic syre, palmitinsyre og stearinsyre, som vist nedenfor. Dette betyr at når de stable sammen pent på et molekylært nivå, både før og etter forsåpning, forming vanskeligere såper (og vanskeligere blokkeringer i arterier, hvis du spiser dem)., Såper laget av mettede fettsyrer er også mer effektive i rengjøring – men dette betyr at de stripe mer naturlig olje bort fra huden din, så vel.
Klikk på bildet for å se større versjon
Umettede fettsyrer har knekk i deres struktur, på grunn av at det ikke er dobbeltbindinger (bits der zig zag blir to parallelle linjer)., Felles umettede fettsyrer som brukes i såpe-gjør er oljesyre, linolsyre, alfa – og gamma-linolensyre (disse er også kjent som omega-fettsyrer – igjen, noe du kan ha kommet over før i sammenheng med ernæring), og ricinoleic syre. På grunn av deres kinky form, de ikke stable pent på et molekylært nivå, og kan skyve rundt med masse hull, som betyr at du ender opp med mykere såpestykker (og de ikke tetter blodårene hvis du spiser dem). Såper laget av umettede fettsyrer er mindre effektive i rengjøring, og er derfor skånsom mot huden.,
, Så vel som hardheten av såpe og dens rensende krefter, mengden av hver saponified fettsyrer i den endelige såpe vil også påvirke hvordan skumme oppfører seg. Generelt, mettede fettsyrer vil gi deg en kremet, stabilt skum, mens umettede fettsyrer vil resultere i en lun, men ustabil skum. Ett unntak er skjønt ricinoleic syre (funnet i castor olje), som er umettet, men gir en rik, fluffy skum som er ganske stabil også. Umettede fettsyrer har også en tendens til å gå harsk mer lett, som den doble bindingen kan reagere.,
(Side merk: dyr og planter-og fettstoffer og oljer er triglyserider – mineral olje og andre oljer utvunnet fra olje og gass, på den annen side, er de ikke triglyserider, så det er umulig å lage såpe fra dem.)
Du kan også enkelt se opp fatty acid profiler av vanlig fett og oljer – de vil variere for hver batch av olje, slik at de er virkelig ballpark tall., Her er de tre oljer jeg vil være med i prosjektet (info fra denne fantastiske såpe kalkulator):
Sterk Base
baser brukes for soapmaking må inneholde hydroxide – det er litt som fungerer for å bryte opp fett eller olje i glyserin og såpe. Natriumhydroksid og kaliumhydroksid er de 2 mest brukte baser for forsåpning.
natriumhydroksid (også kjent som lye eller kaustisk soda) er det mest brukte, og resulterer i en vanskelig bar. Kaliumhydroksid resulterer i en myk bar, og brukes vanligvis for å lage flytende såpe., Grunnen til forskjellen er at natrium ion er en som er litt mindre enn kalium ion – det går mindre med stabling av såpe molekyler på et molekylært nivå, og akkurat som med mettet vs. umettede fettsyrer ovenfor, er det mer effektivt å stable, jo hardere som følge såpe.
Sikkerhet merk: Sterke baser er ganske ekle ting å leke med – akkurat som sterke syrer, de vil brenne huden din rett utenfor. Husk scene fra Fight Club? Det er ikke bare kunstnerisk lisens – vil du ende opp med en permanent arr!, Jeg vil gå mer inn i den sikkerhetsmessige hensyn for såpeproduksjon i neste innlegg.
Proporsjoner
I reaksjonen diagrammet ovenfor, vil du merke at du trenger 3 base-partikler til å reagere med ett fett eller olje partikkel. Molekyler er latterlig liten, så vi kan ikke sitte og regne ut det nøyaktige antallet vi trenger å blande i vår kjele. De av dere som har studert kjemi vil vite at det er en metode for å beregne prosenter av komponenter, men fettstoffer og oljer har en tendens til å inneholde en blanding av fettsyrer snarere enn en enkelt slags molekyl, så det er ikke en enkel oppgave!,
Heldigvis, det er mange av såpe kalkulatorer og forsåpning tabeller online med forhåndsprogrammerte numre som kan gjøre det skitne arbeidet for oss – her er noen. (Hvis du bruker en spesielt avansert såpe kalkulator, vil det også beregne den predikerte egenskaper av såpe laget fra hva blanding av fett og oljer du har valgt, bare fra %s til hver fettsyrer, som er virkelig kjekk liten.,)
Disse kalkulatorer la oss finne ut hva den perfekte proporsjoner ville være, men husk at vi ikke er i bruk super nøyaktig vitenskapelige instrumenter – vi bruker kjøkken skalaer, som vil veie ganske mange molekyler av (og av ganske få, jeg mener i regionen 2,500,000,000,000,000,000,000 – det er antallet av NaOH partikler i en measly gram). Hvis vi ikke har nok base, vil det være for mye fett/olje igjen på slutten – slapping fett på huden din høres ikke veldig rensing!, På den annen side, hvis vi ikke har nok fett/olje, vi vil ha sterk base venstre over på slutten i såpe bar – ouch!
Den måten vi spille det trygt er av superfatting, som betyr at du legger litt mindre hydroxide enn vi trenger nok til å være trygt, men ikke så mye at såpe ender opp med altfor fet. Dette kalles også en lye rabatt, og er vanligvis rundt 5-8%.
Glyserin
Dette er produkt som er det samme i alle forsåpning reaksjoner., Glyserin er en fuktgiver, fuktighetskrem, som betyr at det trekker vann til huden for å tilføre fuktighet (det er ting som gjør denne DIY nail polish remover så nærende!). Men dette betyr også at det tiltrekker seg vann, til din endelige såpestykke, noe som gjør det slå til grøt hvis du ikke er forsiktig. Kommersielt masse produsert såper vanligvis ta mye av glyserin for å komme seg rundt dette problemet, og noen håndlagde såper gjøre også (ved hjelp av en prosess kalt «salting ut»), men dette er litt mer avansert enn vi trenger for dette prosjektet.,
Oppsummering
- Såper er overflateaktive stoffer, noe som betyr at de løses opp i vann og oljer og kan rengjøre.
- Soapmaking innebærer reagerer fett/oljer med en sterk hydroxide base, for å danne glyserin og såpe (salter av fettsyrer).
- Fett/olje-molekyler (triglyserider) er laget av glyserin kjemisk knyttet til 3-fettsyrer.
- Den spesifikke fettsyrer i fett/oljer du reagerer vil bestemme egenskapene på det endelige såpestykke.,
- Den sterke hydroxide base vil du være med å gjøre et såpestykke vil trolig være sodium hydroxide, som har en høy pH
- for Å beregne hvor mye av hver kjemisk du trenger i din reaksjon, vil du trenger å bruke en såpe kalkulator eller forsåpning bordet.
- vil Du ønsker å ha litt overflødig fett/olje (5-8%) i din oppskrift, fordi å være en tad fettete (har fuktighet) er bedre enn å brenne huden av! Dette kalles superfatting.
Det er kjemien bak soapmaking i en (ganske stor) nøtteskall., Men hvordan kan vi gå fra dette til å, vel… faktisk å ha et såpestykke for å bruke på din bod? Del 2 vil bli alt om prosessen – se deg da!
– >

