Affiliate Disclosure: jeg modtager en lille provision for køb foretaget via tilknyttede links.
midt i at undervise nogle gymnasieelever om kemien i sæbefremstilling, indså jeg, at jeg virkelig virkelig ville prøve at lave noget sæbe selv og skrive om det her. Min skrive-up endte med at blive rigtig lang, så jeg har gjort det til en to-medindehaver – Rate 1 handler om kemi, og Rate 2 handler om den faktiske procedure (som du også kan gøre på hjem med udstyr og kemikalier fra supermarkedet!).,

Du behøver ikke at forstå kemien i sæbe gøre at lave sæbe, men at kende baggrunden betyder, at du kan spille med dine opskrifter og løse eventuelle problemer, du løber ind i med minimal trial-and-error og spild! Det er også meget interessant fra et videnskabeligt synspunkt.
gå til afsnit:
- hvad er sæbe?,
- Gør Sæbe – Forsæbning Reaktion
- Fedtstoffer og Olier
- Stærk Base
- Proportioner
- Glycerin
- Oversigt
Før vi kan starte med nitty gritty af kemiske reaktioner – hvad er sæbe?
Hvad er sæbe?
Hvis du har fulgt mig i et stykke tid, vil du huske mig at nævne kemikalier kaldet overfladeaktive stoffer, som i mit gæstepost om kemofobi på Toast, og i denne ansigtsvaskevejledning., Overfladeaktive stoffer, der er fiks molekyler, der opløses i både vand – og olie-baserede stoffer, hvilket betyder at de kan rense olie ud overflader, og holde blandinger af olie og vand-baserede væsker lykkelige sammen (tror mayonnaise – uden æggeblomme fungerer som et overfladeaktivt stof, holde alt blandet, det ville bare særskilt i vinagrette dressing).
overfladeaktive stoffer har et ladet vandelskende, hydrofil “hoved” og en neutral, oliekærlig, lipofil “hale”.
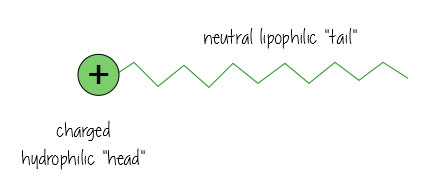
Sådan ser det ud, når det opløses olie i vand (f. eks., i dit beskidte badevand eller holde fedtet opløst i din mælk) – de overfladeaktive stoffer hænger ud i grænsefladen mellem olie og vand og holder alt sammen.
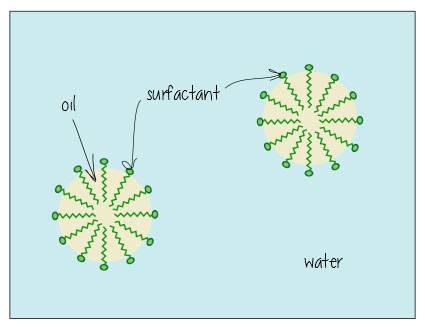
Sæber se noget som dette:
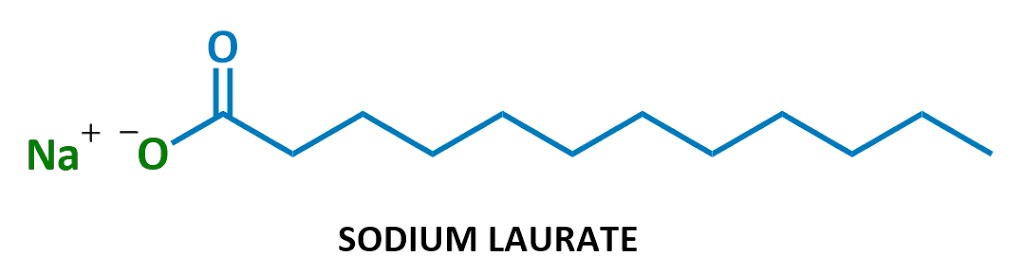
Denne særlige sæbe molekyle kaldet natrium laurat. Når det opløses i vand, splittes natrium (Na+ til venstre) og laurat (resten af diagrammet) op., Her er laurat ion:
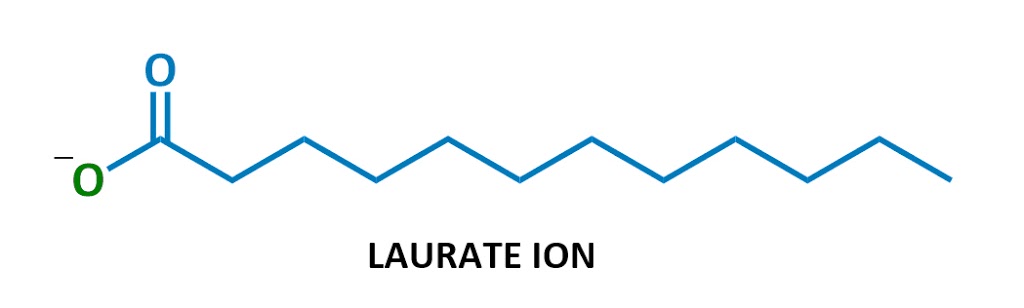
Ser bekendt ud?

Yep, sæber er negativt ladede overfladeaktive stoffer! De er en del af en klasse af kemikalier kaldet anioniske overfladeaktive stoffer (anioniske = negativt ladet), som omfatter de stærkeste rengøringsmidler. (Teknisk sæber kaldes ” salte af fedtsyrer – – jeg vil ikke bruge denne terminologi meget, men det er her, hvis du nogensinde har brug for det.)
så hvordan får vi disse nyttige ting i vores uvorne små hænder?,
Making Soap – Forsæbningsreaktionen
sæbe er lavet af at reagere et fedt eller olie (eller en blanding) med en stærk base (noget med meget høj pH). Den kemiske struktur af fedtstoffer og olier generelt ser ud som dette:
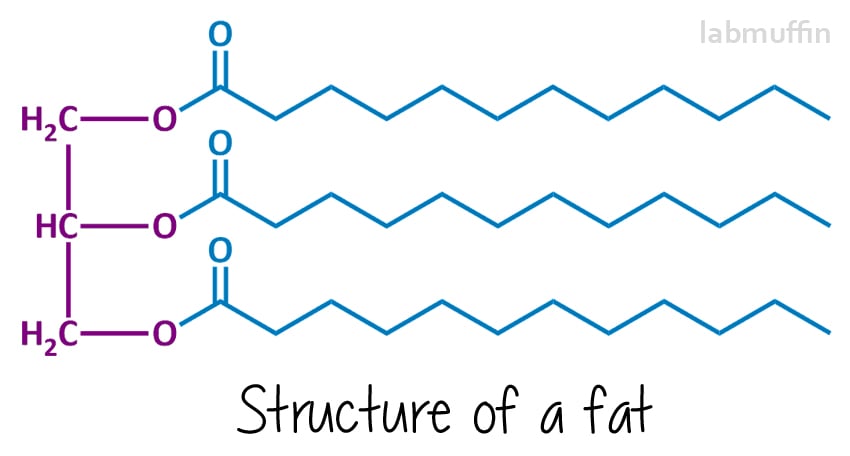
Den venstre side (lilla) er altid det samme – det er baseret på glycerin (også kendt som glycerol) molekyle. Hver ” O ” repræsenterer et iltatom – der er 3 på glycerol, og disse er kemisk bundet til 3 fedtsyrer (i blåt, hvilket vil ende med at blive sæbe)., Disse kan alle være ens eller forskellige (i denne tegning har jeg tegnet dem alle sammen). Fordi der er tre ting, og de er forbundet med et glycerinmolekyle, kaldes fedtstoffer og olier triglycerider.
sæbefremstillingsreaktionen kaldes forsæbning, og efter reaktion siges blandingen at være forsæbning. Forsæbning involverer reaktion af fedt eller olie med en stærk base, normalt natriumhydro .id (aka lud aka kaustisk soda), selvom du også kan bruge kaliumhydro .id (aka kaustisk kaliumchlorid)., Denne reaktion bryder triglyceridet ind i de lilla og blå dele, med andre ord glycerin-og sæbemolekylerne.
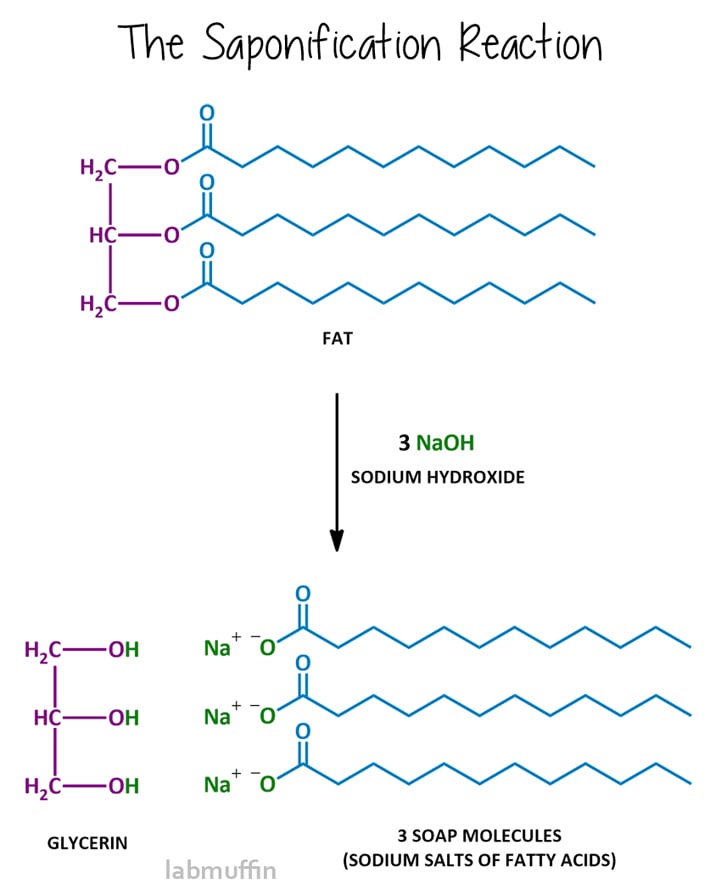
Lad os har et nærmere kig på hver enkelt komponent af den reaktion:
Fedtstoffer og Olier
Dette er den mest komplicerede og interessante del af opskriften. Forskellige fedtstoffer og olier kan bruges til at lave sæber med forskellige egenskaber. I fedtstoffer og olier er fedtsyrerne (det er den blå del, husk) forskellige.
Der er to hovedtyper af fedtsyrer: mættede og umættede., (Dette er det samme som de mættede og umættede fedtstoffer, som du hører om fra diætister!)
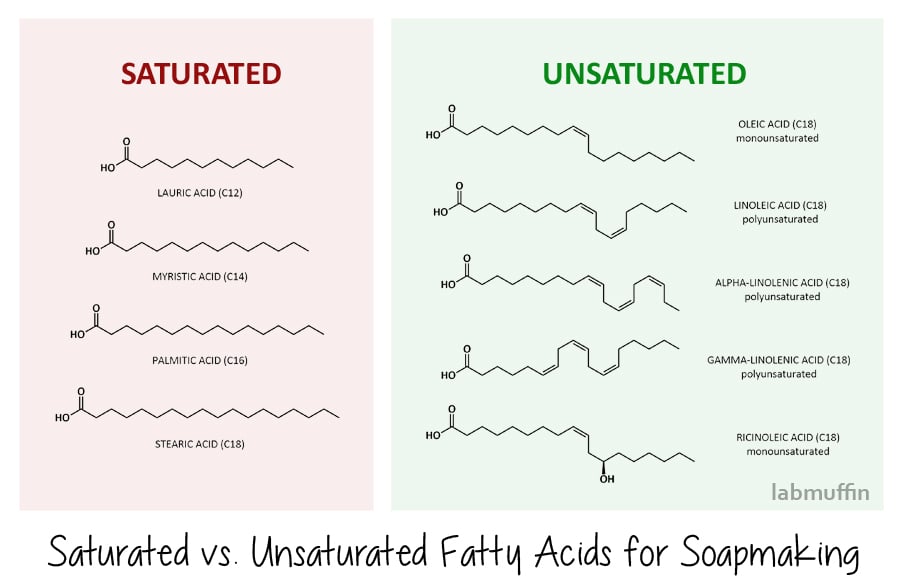
mættede fedtsyrer har en ligetil zig-.ag i deres struktur. De almindelige, vi bruger til sæbefremstilling, er laurinsyre, myristinsyre, palmitinsyre og stearinsyre, vist nedenfor. Det betyder, at når de stabler sammen pænt på molekylært niveau både før og efter forsæbning, danner hårdere Sæber (og hårdere blokeringer i dine arterier, hvis du spiser dem)., Sæber fremstillet af mættede fedtsyrer er også mere effektive til rengøring – men det betyder, at de også fjerner mere naturlig olie fra din hud.
Klik på billedet for at se større version
Umættede fedtsyrer har knæk i deres struktur, skyldes, at der er dobbelt obligationer (bits, hvor den zig zag bliver to parallelle linjer)., Fælles umættede fedtsyrer, der anvendes i sæbe-making er oliesyre, linolsyre, alfa – og gamma-linolensyre (disse er også kendt som omega fedtsyrer – igen, noget, du muligvis er kommet på tværs før i forbindelse med ernæring), og ricinoleic acid. På grund af deres kinky form stabler de ikke pænt på molekylært niveau og kan glide rundt med masser af huller, hvilket betyder at du ender med blødere sæbebarer (og de tilstopper ikke arterier, hvis du spiser dem). Sæber fremstillet af umættede fedtsyrer er mindre effektive til rengøring og er derfor mildere på huden.,
ud over hårdheden af din sæbe og dens rensende kræfter vil mængden af hver forsæbet fedtsyre i den endelige sæbe også påvirke, hvordan skummet opfører sig. Generelt vil mættede fedtsyrer give dig en cremet, stabil skum, mens umættede fedtsyrer vil resultere i en fluffy, men ustabil skum. En bemærkelsesværdig undtagelse er dog ricinoleinsyre (findes i ricinusolie), som er umættet, men giver en rig, fluffy skum, der også er ret stabil. Umættede fedtsyrer har også en tendens til at blive harskere lettere, da dobbeltbindingen kan reagere.,
(Side note: animalske og vegetabilske fedtstoffer og olier er triglycerider – mineralolie og andre olier afledt af råolie er derimod ikke triglycerider, så det er umuligt at lave sæbe fra dem.)
Du kan også nemt slå op fedtsyreprofilerne af almindelige fedtstoffer og olier – de vil variere for hvert parti olie, så de er virkelig ballpark figurer., Her er de tre olier, Jeg bruger i projektet (info fra denne fantastiske sæberegner):
stærk Base
baserne, der bruges til sæbefremstilling, skal indeholde hydro .id – det er den smule, der virker for at opdele fedtet eller olien i glycerin og sæbe. Natriumhydroxid-og kaliumhydroxidopløsning er de 2 mest almindeligt anvendte grundlag for forsæbning.
Natriumhydro .id (også kendt som lUD eller kaustisk soda) bruges mest og resulterer i en hård bar. Kaliumhydro .id resulterer i en blød bar og bruges normalt til fremstilling af flydende sæbe., Årsagen til forskellen er, at natrium-ion er en smule mindre end kalium-ion – det forstyrrer mindre med stabling af sæbe molekyler, der på molekylært plan, og ligesom med mættet vs. umættede fedtsyrer ovenfor, den mere effektive den stabling, jo sværere er den resulterende sæbe.
sikkerhedsnotat: stærke baser er temmelig grimme ting at lege med – ligesom stærke syrer brænder de din hud lige ud. Kan du huske scenen fra Fight Club? Det er ikke kun kunstnerisk licens-du vil ende med et permanent ar!, Jeg vil gå mere ind i sikkerhedsovervejelserne for sæbefremstilling i det næste indlæg.
proportioner
i reaktionsdiagrammet ovenfor vil du bemærke, at du har brug for 3 basepartikler for at reagere med en fedt-eller oliepartikel. Molekyler er latterligt små, så vi kan ikke sidde og tælle det nøjagtige antal, vi har brug for at blande i vores gryde. Dem af jer, der har studeret kemi vil vide, at der er en metode til beregning af nøgletal for komponenter, men fedtstoffer og olier tendens til at indeholde blandinger af fedtsyrer i stedet for en enkelt slags molekyle, så det er ikke en ligetil opgave!,heldigvis er der masser af sæberegnere og forsæbningstabeller online med forprogrammerede numre, der kan gøre det beskidte arbejde for os – her er et par stykker. (Hvis du bruger en særlig avanceret sæbe lommeregner, vil det også beregne de forudsagte egenskaber af sæbe fremstillet af uanset blanding af fedtstoffer og olier, du har valgt, lige fra %S af hver fedtsyre, som er virkelig fiks.,)
Disse regnemaskiner lad os finde ud af, hvad de perfekte proportioner ville være, men husk, at vi ikke bruger super præcise videnskabelige instrumenter – vi bruger køkkenvægt, der vejer ganske få molekyler (og ved en hel del, jeg mener i regionen 2,500,000,000,000,000,000,000 – det er antallet af NaOH partikler i en sølle gram). Hvis vi ikke har nok base, vil der være for meget fedt/olie tilbage i slutningen-slapping fedt på din hud lyder ikke meget rensende!, På den anden side, hvis vi ikke har nok fedt/olie, har vi en stærk base tilbage i slutningen i sæbebaren – ouch!
den måde, vi spiller det sikkert på, er ved superfatting, hvilket betyder at tilføje lidt mindre hydro .id end vi har brug for – nok til at være sikker, men ikke så meget, at sæben ender for fedtet. Dette kaldes også en lUD rabat, og er normalt omkring 5-8%.
Glycerin
Dette er det produkt, der er det samme i alle forsæbningsreaktioner., Glycerin er en fugtgivende fugtighedscreme, hvilket betyder, at den trækker vand til huden for at tilføje fugt (det er de ting, der gør denne DIY neglelakfjerner så nærende!). Dette betyder dog også, at det tiltrækker vand til din sidste sæbestang, hvilket får det til at blive grød, hvis du ikke er forsigtig. Kommercielt masseproducerede sæber fjerner normalt meget glycerin for at omgå dette problem, og nogle håndlavede sæber gør også (ved hjælp af en proces kaldet “saltning ud”), men dette er lidt mere avanceret, end vi har brug for til dette projekt.,
resum.
- sæber er overfladeaktive stoffer, hvilket betyder, at de opløses i vand og olier og kan rense.
- sæbefremstilling indebærer omsætning af fedtstoffer / olier med en stærk hydro .idbase for at danne glycerin og sæbe (salte af fedtsyrer).
- fedt / olie molekyler (triglycerider) består af glycerin kemisk bundet til 3 fedtsyrer.
- de specifikke fedtsyrer i fedtstoffer / olier du reagerer vil bestemme egenskaberne af din endelige bar af sæbe.,
- stærk base natriumhydroxid, som du vil bruge til at foretage en bar af sæbe vil sandsynligvis være natriumhydroxid, som har en høj pH-værdi
- til At beregne, hvor meget af hver kemiske du har brug for i din reaktion, du bliver nødt til at bruge en sæbe lommeregner eller forsæbning bordet.
- du vil gerne have lidt overskydende fedt/olie (5-8%) i din opskrift, fordi det at være en smule fedtet (fugtet) er bedre end at brænde din hud af! Dette kaldes superfatting.
det er kemien bag sæbefremstilling i et (ret stort) nøddeskal., Men hvordan går vi fra dette til, ja… faktisk at have en bar af sæbe til at bruge på din bod? En del 2 handler om processen-se dig derefter!

