surhedsgrad af aromatiske forbindelser
Men se nu på anionen afledt af dette kemikalie-den ion, der ville resultere, hvis dette kemikalie opførte sig som en syre og afgav en h+; denne ion er også vist nedenfor. Bemærk, at det nu har seks elektroner i p orbitaler vinkelret på ringen – meget lig pyrrol, ovenfor. Hvis pyrrol er aromatisk, så skal denne ion måske være? Jo, det er., En manifestation af dette er, at moderforbindelsen, cyclopentadien, er en ret “stærk” syre – ved standarderne for H knyttet til kulbrinter. Surheden af cyclopentadien skyldes stabiliseringen af den resulterende anion. Ka for cyclopentadien er omkring 10-16. Det er bestemt ikke stærkt sammenlignet med forbindelser, der ofte diskuteres som syrer, men det er 1029 gange stærkere end for den ikke-cykliske form af dette molekyle.
nu har vi set en række kemiske arter, både neutrale molekyler og ioner, der er aromatiske., De deler det fælles træk, at de alle har 6 elektroner i en kontinuerlig løkke af overlappende p orbitaler. Viser sig, at dette stadig ikke er en tilstrækkelig bred beskrivelse af, hvad der gør en kemisk aromatisk.
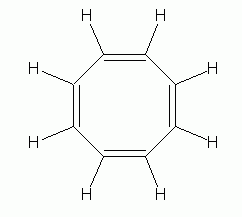 |
Et interessant eksempel er 1,3,5,7-cyclooctatetraene (ofte blot kaldet cyclooctatetraene), C8H8, der er vist til venstre. Ved første øjekast ser det ud til at ligne ben .en, undtagen med en større ring. Men det er bestemt ikke aromatisk., Dens kemiske opførsel er, hvad du ville forvente for en alken, og dens form er ikke plan, men er “karbadformet”, som vist til højre. |
|
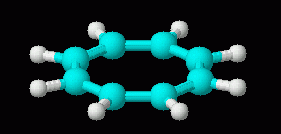
Nu, ikke-aromatiske karakter af cyclooctatetraene alene er ikke alt for svært at forklare. Når alt kommer til alt, hvis det var aromatisk og plan, ville det have bindingsvinkler på 135 grader. Det er betydeligt mere end den enkle sp2-bindingsvinkel på 120 grader., Så vi kan foreslå, at bindingsvinkelstammen i den plane form mere end kompenserer for enhver gevinst på grund af aromaticitet. Der er dog mere til historien. Viser sig, at det er forholdsvis let for cyclooctatetraene at få 2 elektroner, der danner dianion, C8H82-. Denne ion er plan, og er aromatisk. To tegninger af denne ion er nedenfor, efterfulgt af en 3D-model.,/div>
 |
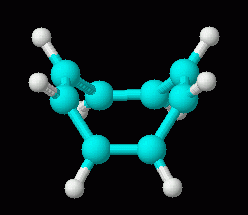 |
| cyclooctatetraene dianion, C8H82-, 3D | cyclooctatetraene, C8H8, 3D (neutral; repeated from above, for comparison of the 3D shapes of molecule and ion) |
So what do we learn from the story of cyclooctatetraene and its dianion?, Før overvejer dette, alle vores eksempler på aromaticity havde seks elektroner i electr electron loop. Cyclooctatetraene har otte, og er ikke aromatisk; dens dianion har ti, og er aromatisk. Så klart er seks ikke det eneste tilladte nummer.
undersøgelse af mange molekyler og ioner samt teoretisk arbejde, der ligger langt ud over vores kursus, har indikeret, at en art vil være aromatisk, hvis der er 4n+2 elektroner i en plan π elektronsløjfe-hvor n er ethvert heltal, startende med 0. (Dette er kendt som H .ckels regel.) 0?, Det ville betyde, at en electr-elektronsløjfe med to elektroner er aromatisk. Faktisk er kationen afledt af cyclopropen, vist nedenfor, usædvanligt stabil og betragtes som aromatisk.
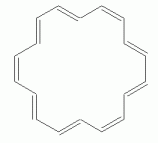
Som et andet eksempel, med en større n, overveje en bestemt isomer af 18-annulene — isomer med hver tredje cis-dobbeltbinding. Følgende sæt tal viser tre repræsentationer af dens struktur.,
 |
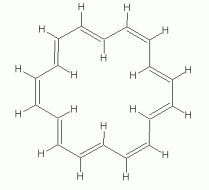 |
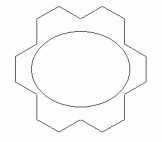 |
If 18-annulene were aromatic (n=4), we might expect it to be planar. In fact, some programs will calculate a planar structure for it., Faktisk måling viser, at det er meget lidt forvrænget fra plan, på grund af afstødningen af hydrogenerne, der er inde i ringen. Nedenstående figur viser 3D repræsentationer af begge “former” af 18-annulene; de er blevet roteret, så du ser dem “kant på”. Den øverste struktur er den plane form, som man naivt kunne forvente; den anden er den lidt forvrængede struktur, som nøje svarer til det, der faktisk observeres.,

Den annulene navn bruges generisk for cykliske molekyler med skiftevis enkelt-og dobbeltbindinger. Det numeriske præfiks angiver ringestørrelsen. Ben .en kan betragtes som 6-annulen, og cyclooctatetraen som 8-annulen. Bemærk, at alle annulleringer har den generelle formel C .h. (hvor must skal være et lige tal), og at udtrykket ikke i sig selv indebærer aromatisk karakter.