Beispiel 2.5.1: Mehrfachresonanz anderer Moleküle
Moleküle mit mehr als einer Resonanzform
Einige strukturelle Resonanzkonformationen sind der Hauptverursacher oder die dominanten Formen, in denen das Molekül existiert. Wenn wir uns beispielsweise die obigen Regeln zur Schätzung der Stabilität eines Moleküls ansehen, sehen wir, dass für das dritte Molekül die erste und die zweite Form die Hauptfaktoren für die Gesamtstabilität des Moleküls sind., Der Stickstoff ist elektronegativer als Kohlenstoff, so dass er die negative Ladung mehr als Kohlenstoff verarbeiten kann. Ein Kohlenstoff mit einer negativen Ladung ist die ungünstigste Konformation für das Molekül, so dass die letzte Resonanzform sehr wenig zur Stabilität des Ions beiträgt.
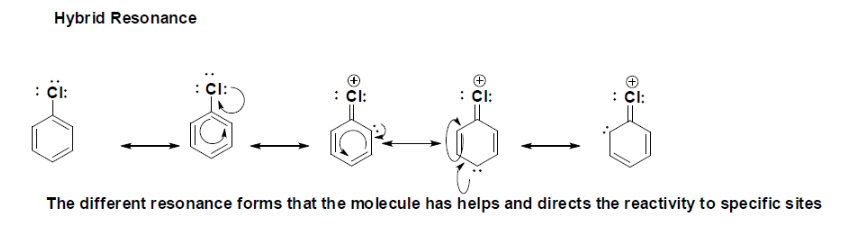
Die hybriden Resonanzformen zeigen die verschiedenen Lewis-Strukturen mit dem delokalisierten Elektron., Dies ist sehr wichtig für die Reaktivität von Chlorbenzol, da es in Gegenwart eines Elektrophils reagiert und die Bildung einer anderen Bindung durch Resonanz geleitet und bestimmt wird. Das lange Elektronenpaar, das in dem aromatisch substituierten Ring delokalisiert ist, ist dort, wo es möglicherweise eine neue Bindung mit einem Elektrophil bilden kann, wie es gezeigt wird, gibt es drei mögliche Stellen, an denen Reaktivität stattfinden kann, wobei die erste Reaktion an der Para-Position in Bezug auf den Chlorsubstituenten und dann auf die Ortho-Position stattfindet.