The chemical element palladium is classed as a transition metal. It was discovered in 1803 by William H. Wollaston.

Data Zone
| Classification: | Palladium is a transition metal |
| Color: | silvery-white |
| Atomic weight: | 106.,4 |
| State: | solid |
| Melting point: | 1555 oC, 1828 K |
| Boiling point: | 2960 oC, 3233 K |
| Electrons: | 46 |
| Protons: | 46 |
| Neutrons in most abundant isotope: | 60 |
| Electron shells: | 2,8,18,18 |
| Electron configuration: | 4d10 |
| Density @ 20oC: | 12.,02 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 8.9 cm3/mol |
| Structure: | ccp (cubic close-packed) |
| Hardness: | 4.8 mohs |
| Specific heat capacity | 0.24 J g-1 K-1 |
| Heat of fusion | 17.60 kJ mol-1 |
| Heat of atomization | 378 kJ mol-1 |
| Heat of vaporization | 357.,0 kJ mol-1 |
| 1st ionization energy | 804.7 kJ mol-1 |
| 2nd ionization energy | 1894 kJ mol-1 |
| 3rd ionization energy | 3177.2 kJ mol-1 |
| Electron affinity | 53.7 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 2.,2 |
| polariseerbaarheid volume | 4., |
| Oxide(s) | PdO, PdO2 |
| Hydride(s) | PdH2 |
| Chloride(s) | PdCl2 |
| Atomic radius | 137 pm |
| Ionic radius (1+ ion) | 73 pm |
| Ionic radius (2+ ion) | 78pm |
| Ionic radius (3+ ion) | 90 pm |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 71.,8 W m-1 K-1 | elektrisch geleidingsvermogen | 10 x 106 S M-1 | invriezen/smeltpunt: | 1555 oC, 1828 K |

afbeelding op nanoschaal van het palladiummetaaloppervlak. Afbeelding Ref.(1)
ontdekking van Palladium
Palladium werd in 1803 in Londen ontdekt door de Engelse chemicus William Wollaston (die ook rhodium in hetzelfde jaar ontdekte).,hij onderzocht de resten van platina na oplossing in aqua regia, een geconcentreerde oplossing van zoutzuur en salpeterzuren. Vervolgens isoleerde hij palladium in een reeks chemische reacties en verhitte uiteindelijk palladiumcyanide om palladiummetaal te extraheren.Wollaston deelde zijn ontdekking op een onconventionele manier. Hij liet een hoeveelheid van het metaal te koop staan bij een mineralenhandelaar in Gerrard Street, Londen, en plaatste anoniem handboeken door de hele stad, waarin hij de eigenschappen van het nieuwe metaal beschreef., Richard Chenevix, een beroemde chemicus in die tijd, verklaarde palladium als een platina-kwiklegering. (2)
In reactie daarop bood Wollaston anoniem een beloning van twintig guineas aan iedereen die kunstmatig palladium kon produceren. Niemand heeft dit geld opgeëist.in 1805 sprak Wollaston voor de Royal Society of London over palladium ‘ s eigenschappen en hoe het geïsoleerd kon worden van platina. Hij beëindigde zijn toespraak door zich te openbaren als de ontdekker van palladium.,
hij legde uit dat hij anoniem was gebleven zodat hij de tijd had om alle eigenschappen van het metaal te begrijpen en uit te leggen voordat hij zijn naam op een account zette. (3)
het element is vernoemd naar de toen recent ontdekte asteroïde Pallas. De naam van de asteroïde verwijst naar de oude Griekse godin van de wijsheid., (4)


Het is mogelijk dat een aantal van de Aarde metalen aangekomen met de asteroïde en comet impact na van de planeet had al gevormd, en uitleggen waarom de dichte metalen palladium, goud en platina zijn beschikbaar op relatief korte afstand van onze planeet oppervlak. Foto van NASA.
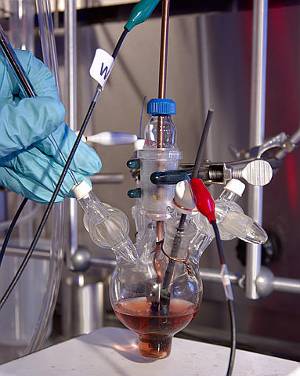
Palladium wordt vaak gebruikt als katalysator., Hier wordt het gebruikt om de reductie van kooldioxide tot koolmonoxide te katalyseren. Afbeelding door PNL.
uiterlijk en kenmerken
schadelijke effecten:
Palladium wordt geacht een lage toxiciteit te hebben.
kenmerken:
Palladium is een zeldzaam, glanzend, zilverwit metaal. het is een van de zes platinametalen bestaande uit platina, palladium, rhodium, osmium, iridium en ruthenium.
de platinagroep metalen
Deze metalen hebben vergelijkbare eigenschappen en zijn vaak aanwezig in dezelfde minerale ertsen.,
| 44 Ru |
45 Rh |
46 Pd |
| 76 Os |
77 Ir |
78 Pt |
Palladium is smeedbaar en nodulair en zoals goud, het kan worden geslagen in dunne blad.
het tast niet aan in de lucht, maar licht aan in vochtige zwavelhoudende lucht.
het metaal is bij normale temperaturen sterk bestand tegen corrosie in de lucht en tegen de werking van zuren (behalve salpeterzuur).,
wanneer palladium aanwezig is in verbindingen, bestaat het voornamelijk in oxidatietoestand II.
Palladium is opmerkelijk in zijn capaciteit om tot 900 maal zijn eigen volume waterstof op te nemen. Als het de waterstof absorbeert, zet het zichtbaar uit, zoals een spons die opzwelt bij het absorberen van water.
gebruik van Palladium
het grootste gebruik van palladium is in katalysatoren voor auto ‘ s.
fijn gedeeld palladium wordt gebruikt als katalysator voor hydrogenering/dehydrogeneringsreacties en voor petroleumkraken.,
het metaal wordt gebruikt in sieraden, bijvoorbeeld in witgoud (een legering van goud ontkleurd door de toevoeging van palladium).
Palladium wordt gebruikt in de tandheelkunde, horlogemakerij en bij het maken van chirurgische instrumenten en elektrische contacten.
Het wordt ook gebruikt om waterstof te zuiveren omdat het gas gemakkelijk diffundeert door verhit palladium., abundantie en isotopen
abundantie aardkorst: 15 gewichtsdelen per miljard, 2 gewichtsdelen per miljard mol
abundantie zonnestelsel: 3 gewichtsdelen per miljard, 40 gewichtsdelen per biljoen mol
kosten, zuiver: $ 5833 per 100 g
kosten, bulk: $ 1571 per 100 g
bron:Palladium komt in de natuur voor als een vrij metaal en ook met goud gelegeerd; platina, en andere platina groep metalen. Commercieel wordt het geproduceerd uit nikkel-koperertsafzettingen waar het in kleine hoeveelheden wordt gevonden.,

- Foto door PNNL
- Thomas Wood, the Action of Carbon on Palladium: Inaug. Diss. van de Georgia Augusta University, Göttingen, 1859, T. Chapman Browne, p4-6
- R. Hastings, The Chemist, Volume 7, 1846, George Peirce., P388-389
- Mary Elvira Weeks, The Discovery of the Elements VIII. The Platinum Metals, Journal of Chemical Education., Juni 1932, p1022.,
Cite this Page
kopieer en plak een van de volgende links:
<a href="https://www.chemicool.com/elements/palladium.html">Palladium</a>
of
<a href="https://www.chemicool.com/elements/palladium.html">Palladium Element Facts</a>
om deze pagina in een academisch document te citeren, gebruik dan de volgende MLA-compliant citation:
"Palladium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/palladium.html>.