farmakoterapeutisk klassifikation: Lægemidler, der anvendes inden for diabetes -, blod-glukose sænkende medicin, bortset fra insuliner. ATC-kode: A10BK02.
virkningsmekanisme
SGLT2-transportøren, udtrykt i de proksimale nyretubuli, er ansvarlig for størstedelen af reabsorptionen af filtreret glucose fra det rørformede lumen., Patienter med diabetes har vist sig at have forhøjet renal glukoseabsorption, hvilket kan bidrage til vedvarende forhøjede blodglukosekoncentrationer. Canagliflo .in er en oralt aktiv hæmmer af SGLT2. Ved at hæmme SGLT2, canagliflozin reducerer reabsorption af filtreret glukose og sænker renal tærskel for glucose (RTG), og øger dermed UGE, sænke forhøjet plasma glukose koncentrationen af denne insulin-uafhængig mekanisme i patienter med type 2-diabetes., Den øgede UGE med SGLT2 hæmning kan også overføres til en osmotisk diurese, med den vanddrivende effekt, der fører til en reduktion i systolisk blodtryk; stigningen i UGE resulterer i et tab af kalorier og derfor en reduktion i kropsvægt, som er blevet påvist i studier af patienter med type 2-diabetes.
Canagliflo .ins virkning på at øge UGE direkte sænkning af plasmaglucose er uafhængig af insulin., Forbedring i homeostasemodelvurdering for beta-cellefunktion (HOMA-beta-celle) og forbedret beta-celle insulinsekretionsrespons på en blandet måltidsudfordring er blevet observeret i kliniske studier med canagliflo .in.
I fase 3 undersøgelser, pre-måltid administration af canagliflozin 300 mg givet en større reduktion i postprandial glucose udflugt end observeret med 100 mg dosis., Denne effekt på 300 mg dosis af canagliflozin kan dels være på grund af lokale hæmning af den intestinale SGLT1 (en vigtig tarm-glucose transporter), der er relateret til forbigående høje koncentrationer af canagliflozin i tarmens lumen før lægemiddel absorption (canagliflozin er en lav styrke inhibitor af SGLT1 transporter). Undersøgelser har ikke vist nogen glukosemalabsorption med canagliflo .in.,
Canagliflozin øger levering af natrium til den distale tubuli ved at blokere SGLT2-afhængige af glukose og natrium reabsorption og derved øge tubuloglomerular feedback, som er forbundet med en reduktion i intraglomerular pres og et fald i hyperfiltration i prækliniske modeller af diabetes og kliniske undersøgelser.
Farmakodynamiske virkninger
Efter enkelt og flere orale doser af canagliflozin til patienter med type 2-diabetes, dosis-afhængige falder i RTG og stigninger i UGE blev observeret., Fra et udgangspunkt værdien af RTG af ca 13 mmol/L, maksimal dæmpning af 24-timers betyde, RTG blev set med 300 mg daglig dosis til cirka 4 mmol/L til 5 mmol/L hos patienter med type 2-diabetes i fase 1 undersøgelser, tyder på en lav risiko for behandling-induceret hypoglykæmi. De reduktioner i RTG ført til øget UGE hos forsøgspersoner med type 2-diabetes behandlet med enten 100 mg eller 300 mg canagliflozin lige fra 77 g/dag til 119 g/dag i fase 1-studier; den UGE observeret svarer til et tab af 308 kcal/dag til 476 kcal/dag., Reduktionerne i RTG og stigninger i UGE blev opretholdt over en 26-ugers doseringsperiode hos patienter med type 2-diabetes. Der sås Moderate stigninger (generelt < 400 mL til 500 mL) i det daglige urinvolumen, som blev svækket over flere dages dosering. Udskillelsen af urinsyre udskillelse var forbigående øget med canagliflozin (steg med 19% i forhold til baseline på dag 1 og derefter formildende til 6% på dag 2 og 1% på dag 13). Dette blev ledsaget af en vedvarende reduktion i serum urinsyrekoncentration på cirka 20%.,
i en enkeltdosisundersøgelse hos patienter med type 2-diabetes forsinkede behandling med 300 mg før et blandet måltid intestinal glukoseabsorption og reducerede postprandial glukose gennem både en nyre-og en ikke-renal mekanisme.
Klinisk effekt og sikkerhed
Forbedring i glykæmisk kontrol og reduktion af kardiovaskulær og renal sygdom og død er en integreret del af behandlingen af type 2-diabetes.,
Glykæmisk effekt og sikkerhed
alt 10,501 patienter med type 2-diabetes deltog i ti-dobbelt-blinde, kontrollerede kliniske effekt og sikkerhed undersøgelser, der er gennemført for at vurdere virkningerne af Invokana på glykæmisk kontrol. Racefordelingen var 72% Hvid, 16% Asiatisk, 5% sort og 8% andre grupper. 17% af patienterne var latinamerikanske. 58% af patienterne var mænd. Patienterne havde en samlet gennemsnitsalder på 59, 5 år (mellem 21 og 96 år) med 3, 135 patienter ≥ 65 år og 513 patienter.75 år. 58% af patienterne havde et kropsmasseindeks (BMI). 30 kg/m2., I det kliniske udviklingsprogram, 1,085 patienter med en baseline eGFR 30 mL/min/1.73 m2 < 60 mL/min/1.73 m2, blev evalueret.
Placebo-kontrollerede undersøgelser
Canagliflozin blev undersøgt som monoterapi, dual behandling med metformin, dual behandling med sulphonylurea, tredobbelt behandling med metformin og et sulphonylurea, tredobbelt behandling med metformin og pioglitazone, og som et add-on terapi med insulin (tabel 4). Generelt producerede canagliflo .in klinisk og statistisk signifikant (p < 0.,001) resultater i forhold til placebo på glykæmisk kontrol, herunder HbA1c, den procentdel af patienterne opnå HbA1c < 7%, ændring fra baseline faste plasma glukose (FPG), og 2-timers postprandial glukose (PPG). Derudover blev der observeret reduktioner i kropsvægt og systolisk blodtryk i forhold til placebo.,
Desuden, canagliflozin blev undersøgt som tredobbelt behandling med metformin og sitagliptin og doseres med en titrering regime, ved hjælp af en startdosis på 100 mg og titreres til 300 mg så tidligt som i uge 6 i patienter, der kræver yderligere glykæmisk kontrol, der havde passende eGFR og var tolerere canagliflozin 100 mg (tabel 4). Canagliflozin doseres med en titrering regime produceret klinisk og statistisk signifikant (p < 0.,001) resultater i forhold til placebo på glykæmisk kontrol, herunder HbA1c og ændring fra baseline faste plasma glukose (FPG), og en statistisk signifikant (p < 0.01) forbedring i andelen af patienter at opnå HbA1c < 7%. Derudover blev der observeret reduktioner i kropsvægt og systolisk blodtryk i forhold til placebo.,
ud over de undersøgelser, der er præsenteret ovenfor, glykæmisk effektivitet resultater, der er observeret i en 18-uge dual terapi sub-studie med sulphonylurea, og en 26-uge tredobbelt terapi undersøgelse med metformin og pioglitazone generelt var sammenlignelige med dem, der er observeret i andre undersøgelser.
Aktiv-kontrollerede undersøgelser
Canagliflozin blev sammenlignet med glimepirid som dual behandling med metformin og sammenlignet med sitagliptin som tredobbelt behandling med metformin og et sulphonylurea (tabel 5)., Canagliflozin 100 mg som dual behandling med metformin produceret lignende reduktioner i HbA1c fra baseline og 300 mg produceret superior (p < 0.05) reduktioner i HbA1c sammenlignet med glimepirid, og dermed demonstrere ikke-mindreværd. En mindre andel af patienter behandlet med canagliflozin 100 mg (5,6%) og canagliflozin 300 mg (4.9%) oplevet mindst én episode/tilfælde af hypoglykæmi over 52 ugers behandling i forhold til gruppen behandlet med glimepirid (34.2%)., I en undersøgelse, der sammenligner canagliflozin 300 mg til 100 mg sitagliptin i tredobbelt behandling med metformin og et sulphonylurea, canagliflozin vist ikke ringere (p < 0.05) og superior (p < 0.05) reduktion i HbA1c i forhold til sitagliptin. Forekomsten af hypoglykæmi-episoder/hændelser med canagliflozin 300 mg og 100 mg sitagliptin var 40.7% og 43,2%, henholdsvis. Der blev også observeret signifikante forbedringer i kropsvægt og reduktioner i systolisk blodtryk sammenlignet med både glimepirid og sitagliptin.,
Canagliflozin som indledende kombinationsbehandling med metformin
Canagliflozin blev evalueret i kombination med metformin som første kombinationsbehandling hos patienter med type 2-diabetes svigter kost og motion. Canagliflozin 100 mg og canagliflozin 300 mg i kombination med metformin XR resulterede i en statistisk signifikant større forbedring i HbA1C i forhold til deres respektive canagliflozin doser (100 mg og 300 mg) alene eller metformin XR alene (tabel 6).,
Specielle populationer
I tre undersøgelser, der er gennemført i specielle populationer (ældre patienter, patienter med en eGFR af 30 mL/min/1.73 m2 < 50 mL/min/1.73 m2, og patienter, med eller høj risiko for hjerte-kar-sygdomme), canagliflozin blev tilføjet til patienternes aktuelle stabile diabetes behandlinger (kost, monoterapi eller kombinationsbehandling).,
Ældre
i alt 714 patienter ≥ 55 år til ≤ 80 år (227 patienter (65 år af alder < 75 år, og 46 patienter på 75 år for at ≤ 80 år) med utilstrækkelig glykæmisk kontrol på nuværende diabetes behandling (glukose-sænkende lægemidler og/eller kost og motion), der har deltaget i en dobbelt-blind, placebo-kontrolleret undersøgelse over 26 uger. Er statistisk signifikant (p < 0.001) ændringer fra baseline HbA1c i forhold til placebo af -0.57% og -0.,70% blev observeret for henholdsvis 100 mg og 300 mg (se Afsnit 4. 2 og 4. 8).
Patienter med eGFR 45 mL/min/1.73 m2 < 60 mL/min/1.73 m2
I en samlet analyse af patienterne (N = 721) med en baseline eGFR 45 mL/min/1.73 m2 < 60 mL/min/1.73 m2, canagliflozin forudsat klinisk meningsfuld reduktion i HbA1c sammenlignet med placebo, med -0.47% for canagliflozin 100 mg og -0.52% for canagliflozin 300 mg. Patienter med en baseline eGFR 45 mL/min/1.73 m2 < 60 mL/min/1.,73 m2, der er behandlet med canagliflozin 100 mg og 300 mg udstillet betyde forbedringer i procent ændring i kropsvægt i forhold til placebo af -1.8% og -2.0%, henholdsvis.
størstedelen af patienter med en baseline eGFR 45 mL/min/1.73 m2 < 60 mL/min/1.73 m2 var på insulin, og/eller en sulphonylurea (85% )., I overensstemmelse med den forventede stigning i hypoglykæmi, når et lægemiddel, der ikke er forbundet med hypoglykæmi, tilsættes insulin og/eller sulfonylurinstof, sås en stigning i hypoglykæmi episoder/hændelser, når canagliflo .in blev tilsat insulin og/eller sulfonylurinstof (se Afsnit 4.8).
Faste plasma glukose
I fire placebo-kontrollerede undersøgelser, behandling med canagliflozin som monoterapi eller add-on terapi med en eller to oral glukose-sænkende lægemidler resulterede i at betyde ændringer fra baseline i forhold til placebo i FPG af -1.2 mmol/L -1 til.,9 mmol/L for canagliflozin 100 mg og -1.9 mmol/L til -2.4 mmol/L for canagliflozin 300 mg, hhv. Disse reduktioner blev opretholdt i behandlingsperioden og næsten maksimal efter den første behandlingsdag.
Postprandial glukose
ved Hjælp af et blandet måltid udfordring, canagliflozin som monoterapi eller add-on terapi med en eller to oral glukose-sænkende lægemidler reduceret postprandial glukose (PPG) fra baseline i forhold til placebo ved -1.5 mmol/L til -2.7 mmol/L for canagliflozin 100 mg og -2.1 mmol/L til -3.,5 mmol / l for henholdsvis 300 mg på grund af reduktioner i glukosekoncentrationen før måltidet og reducerede postprandiale glukoseudflugter.
kropsvægt
Canagliflo .in 100 mg og 300 mg som monoterapi og som dobbelt eller tredobbelt tillægsbehandling resulterede i statistisk signifikante reduktioner i procentdelen af kropsvægt efter 26 uger i forhold til placebo., I to 52-ugers aktiv-kontrollerede undersøgelser, der sammenligner canagliflozin til glimepirid og sitagliptin, vedvarende og statistisk signifikant betyde, at reduktioner i procent af kropsvægten for canagliflozin som add-on terapi til metformin blev -4.2% og -4.7% for canagliflozin 100 mg og 300 mg, henholdsvis i forhold til kombinationen af glimepirid og metformin (1,0%) og -2.5% for canagliflozin 300 mg i kombination med metformin og et sulphonylurea sammenlignet med sitagliptin i kombination med metformin og et sulphonylurea (0.3%).,
En undergruppe af patienter (N = 208) fra aktiv-kontrolleret dual terapi undersøgelse med metformin, som gennemgik dual energy X-ray densitometri (DXA) og abdominal computertomografi (CT) scanninger til vurdering af kroppens sammensætning viste, at cirka to tredjedele af vægttab med canagliflozin var på grund af tab af fedtmasse med tilsvarende mængder af antiamerikanisme og abdominalt subkutant fedt at blive tabt. To hundrede elleve (211) patienter fra den kliniske undersøgelse hos ældre patienter deltog i en underundersøgelse af kropssammensætning ved hjælp af D .a-kropssammensætningsanalyse., Dette viste, at ca. to tredjedele af vægttabet i forbindelse med canagliflo .in skyldtes tab af fedtmasse i forhold til placebo. Der var ingen meningsfulde ændringer i knogletæthed i trabekulære og kortikale regioner.
blodtryk
I placebo-kontrollerede undersøgelser, behandling med canagliflozin 100 mg og 300 mg resulterede i den gennemsnitlige reduktion i systolisk blodtryk på -3.9 mmHg og -5.3 mmHg, henholdsvis i forhold til placebo (-0.1 mmHg) og en mindre effekt på det diastoliske blodtryk med betyde ændringer for canagliflozin 100 mg og 300 mg -2.1 mmHg og -2.,5 mmHg sammenlignet med placebo (- 0, 3 mmHg). Der var ingen mærkbar ændring i hjertefrekvensen.
Patienter med baseline HbA1c > 10% og ≤ 12%
En substudy af patienter med baseline HbA1c > 10% og ≤ 12% med canagliflozin som monoterapi resulteret i reduktioner fra baseline i HbA1c (ikke placebo-justeret) af -2.13% og -2.56% for canagliflozin 100 mg og 300 mg, hhv.,
Hjerte-kar-resultater i LÆRRED Program
effekten af canagliflozin på kardiovaskulære hændelser hos voksne med type 2-diabetes, der havde etableret kardiovaskulær (CV) sygdom eller var i risiko for CVD (to eller flere CV risikofaktorer), blev evalueret i CANVAS-Programmet (integreret analyse af LÆRREDET, og LÆRREDET-R-undersøgelsen). Disse undersøgelser var multi-center, multi-national, randomiseret, dobbeltblind, parallel gruppe, med lignende inklusions-og eksklusionskriterier og patientpopulationer., LÆRREDET Program i forhold til den risiko for at opleve en Større uønsket Hjerte-kar-Tilfælde (MACE), der er defineret som den sammensatte af hjerte-kar-dødsfald, nonfatal myokardieinfarkt og nonfatal slagtilfælde, mellem canagliflozin og placebo på en baggrund af standard af pleje, behandling for diabetes og aterosklerotisk hjerte-kar-sygdom.
på lærred blev forsøgspersoner tilfældigt tildelt 1:1:1 til canagliflo .in 100 mg, canagliflo .in 300 mg eller matchende placebo., I LÆRRED-R, blev forsøgspersonerne randomiseret 1:1 til canagliflozin 100 mg eller matchende placebo, og titrering til 300 mg var tilladt (baseret på tolerance og glykæmisk behov) efter Uge 13. Samtidig antidiabetiske og aterosklerotiske terapier kunne justeres i henhold til standardplejen for disse sygdomme.
alt 10,134 patienter, der blev behandlet (4,327 i LÆRRED og 5,807 i CANVAS-R; alt 4,344 randomiseret til placebo og 5,790 at canagliflozin) for en gennemsnitlig eksponering varighed af 149 uger (223 uger i LÆRRED og 94 uger i CANVAS-R). Vital status blev opnået for 99.,6% af forsøgspersonerne på tværs af undersøgelserne. Den gennemsnitlige alder var 63 år og 64% var mænd. Seksogtres procent af forsøgspersoner havde en historie med etableret hjerte-kar-sygdom, hvor 56% havde en historie med koronar sygdom, 19% med cerebrovaskulær sygdom og 21% med perifer vaskulær sygdom; 14% havde en historie med hjertesvigt.
Den gennemsnitlige HbA1c ved baseline var 8.2% og gennemsnitlig varighed af diabetes var 13,5 år.
Baseline nyrefunktionen var normal eller let nedsat i 80% af patienterne og moderat nedsat hos 20% af patienterne (mean eGFR 77 mL/min/1.73 m2)., Ved baseline blev patienterne behandlet med et eller flere antidiabetika, herunder metformin (77%), insulin (50%) og sulfonylurinstof (43%).
det primære endepunkt i LÆRREDSPROGRAMMET var tiden til første forekomst af en MACE. Sekundære endepunkter inden for en sekventiel betinget hypotesetest var dødelighed af alle årsager og hjerte-kar-dødelighed.
Patienter i den samlede canagliflozin grupper (samlet analyse af canagliflozin 100 mg, canagliflozin 300 mg, og canagliflozin op-øget fra 100 mg til 300 mg) havde en lavere sats af MACE, som i forhold til placebo: 2.69 i forhold til 3.,15 patienter per 100 patient-år (HR af den samlede analyse: 0.86; 95% CI (0.75, 0.97).
baseret på Kaplan-Meier-plottet for den første forekomst af MACE, vist nedenfor, blev reduktionen i MACE i canagliflo .in-gruppen observeret så tidligt som uge 26 og blev opretholdt i resten af undersøgelsen (se figur 1).
Figur 1: Tid til første forekomst af MACE
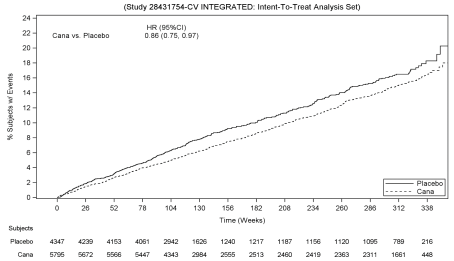
Der var 2,011 patienter med eGFR 30 – < 60 mL/min/1.73 m2. MACE-fundene i denne undergruppe var i overensstemmelse med de overordnede fund.,
hver MACE-komponent bidrog positivt til den samlede sammensætning, som vist i figur 2. Resultaterne for doserne 100 mg og 300 mg canagliflo .in var i overensstemmelse med resultaterne for de kombinerede dosisgrupper.figur 2: behandlingseffekt for det primære sammensatte endepunkt og dets komponenter
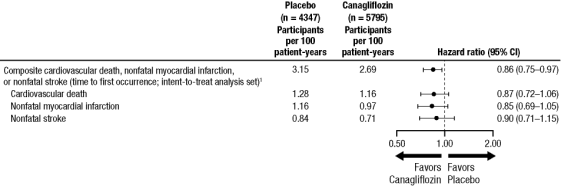
1 p værdi for overlegenhed (2-sidet) = 0, 0158.
mortalitet i LÆRRED Program
I kombineret canagliflozin gruppe, den HØJTSTÅENDE repræsentant for mortalitet versus placebo var 0.87; 95% CI (0.74, 1.01).,
Heart failure, der kræver indlæggelse på LÆRRED Program
Canagliflozin reducerede risikoen for hjerteanfald, der kræver indlæggelse i forhold til placebo (HR: 0.67; 95% CI (0.52, 0.87)).
Renal effektparametre i LÆRRED Program
Renal resultater i TILTRO undersøgelse
effekten af canagliflozin 100 mg på renal hændelser hos voksne med type 2-diabetes og diabetisk nyresygdom (DKD) med en anslået glomerular filtration rate (eGFR) 30 – < 90 mL/min/1.,73 m2 og albuminuri ( 300 til 5000 mg/g kreatinin), blev evalueret i Canagliflozin og Renal Begivenheder i Diabetes med Etablerede Nefropati Klinisk Evaluering af Forsøg (LID). Dette var et multinationalt, randomiseret, dobbeltblindt, event-driven, placebokontrolleret, parallelgruppestudie med flere centre., Den TILTRO undersøgelse har sammenlignet risikoen for at opleve DKD defineret som den sammensatte af end-stage nyresygdom, en fordobling af serum kreatinin, og nyre-eller kardiovaskulær død, mellem canagliflozin 100 mg og placebo på baggrund af en standard for pleje behandlinger for DKD, herunder angiotensin-konverterende enzym-hæmmer (ace-hæmmere) eller angiotensin receptor blokker (ARB). Canagliflo .in 300 mg blev ikke undersøgt i denne undersøgelse.,
I tog imod, blev forsøgspersonerne randomiseret 1:1 til canagliflozin 100 mg eller placebo, opdelt efter screening eGFR 30 – <45, 45 – <60, 60 til <90 mL/min/1.73 m2. Behandling med canagliflo .in 100 mg blev fortsat hos patienter indtil påbegyndelse af dialyse eller i tilfælde af nyretransplantation.
i alt 4.397 forsøgspersoner blev behandlet og eksponeret i gennemsnit 115 uger. Den gennemsnitlige alder var 63 år og 66% var mænd.
Den gennemsnitlige baseline HbA1c var 8.,3% og baseline median urin albumin/kreatinin var 927 mg/g. De mest hyppige antihyperglycaemic agenter (AHA), der anvendes ved baseline var insulin (65.5%), biguanides (57.8%), og sulfonylurinstoffer (28.8%). Næsten alle forsøgspersoner (99, 9%) var på ACEi eller ARB ved randomisering. 92% af forsøgspersonerne var på kardiovaskulære behandlinger (ikke inklusive ACEi / ARBs) ved baseline, hvor cirka 60% tog et antitrombotisk middel (inklusive acetylsalicylsyre) og 69% på statiner.
den gennemsnitlige baseline-eGFR var 56, 2 mL/min / 1.,73 m2, og omkring 60% af befolkningen havde en baseline af eGFR < 60 mL/min/1.73 m2. Andelen af personer med tidligere CV-sygdom var 50, 4%; 14, 8% havde en historie med hjertesvigt.
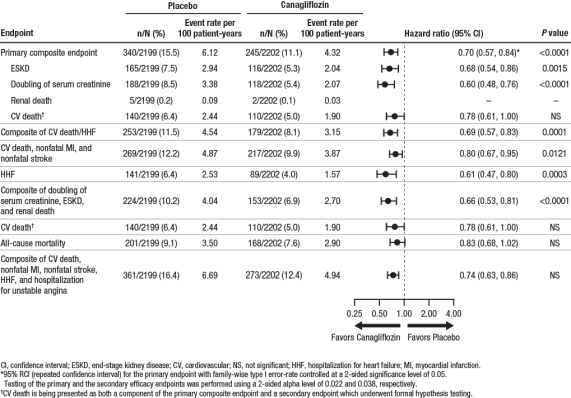
Den primære sammensat endepunkt i den TRO, at undersøgelsen var det tid til første forekomst af ESKD (defineret som en eGFR < 15 mL/min/1.73 m2, indledning af kronisk dialyse eller renal transplantation), en fordobling af serum kreatinin, og nyre-eller CV død.,
Canagliflo .in 100 mg reducerede signifikant risikoen for første forekomst af det primære sammensatte endepunkt af ESKD, fordobling af serumkreatinin og nyre-eller CV-død (se figur 4). Behandlingseffekten var konsistent på tværs af undergrupper, inklusive alle tre eGFR-lag og forsøgspersoner med eller uden en historie med CV-sygdom.
baseret på Kaplan-Meier-plottet for tiden til første forekomst af det primære sammensatte endepunkt vist nedenfor, var behandlingseffekten tydelig fra uge 52 med canagliflo .in 100 mg og blev opretholdt gennem undersøgelsens afslutning (se figur 3).,
Canagliflo Canin 100 mg reducerede signifikant risikoen for kardiovaskulære sekundære endepunkter, som vist i figur 4.
Figur 3: TROVÆRDIGHED: Tid til første forekomst af den primære sammensat endepunkt
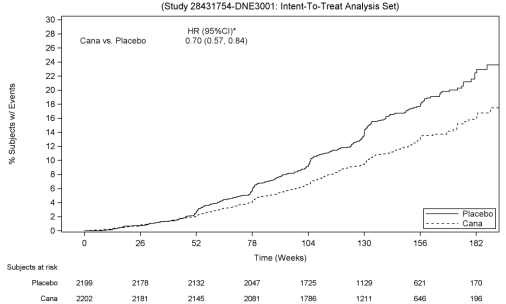
* 95% RCI (Gentagne konfidensinterval) for den primære endpoint med familie-kloge type i-fejl-rate kontrolleres på en 2-sidet signifikans niveau på 0,05.,
Figur 4: effekt af Behandling for den primære sammensat endepunkt og dets komponenter og sekundære endpoints
Som vist i Figur 5, eGFR i de placebo-behandlede patienter viste en progressiv lineær tilbagegang over tid; i modsætning hertil canagliflozin gruppe viste en akut fald i Uge 3, efterfulgt af et svagere fald over tid efter Uge 52, LS betyde fald i eGFR var mindre i canagliflozin-gruppen end i placebogruppen, og behandlingens effekt blev vedligeholdt gennem slutningen af behandlingen.,
Figur 5: LS gennemsnitlig ændring fra baseline i eGFR over tid (på behandling, analyse sæt)
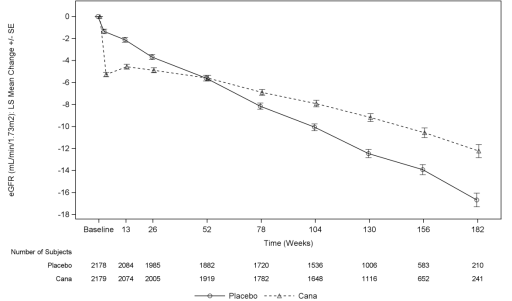
I TRO, incidensraten for nyre-relaterede bivirkninger var lavere i canagliflozin 100 mg gruppen sammenlignet med placebogruppen (5.71 og 7.91 per 100 patient-år i canagliflozin 100 mg og placebo, henholdsvis).
pædiatrisk population
Det Europæiske Lægemiddelagentur har udskudt forpligtelsen til at indsende resultaterne af undersøgelser med canagliflo .in i en eller flere undergrupper af den pædiatriske population med type 2-diabetes (se Afsnit 4.,2 for information om pædiatrisk anvendelse).